Professor Associado, Universidade Fernando
Pessoa
| Outros modelos interactivos: |
| Vias metabólicas: |
|
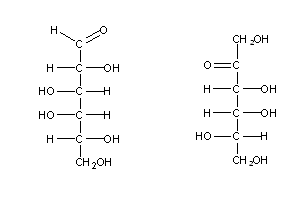
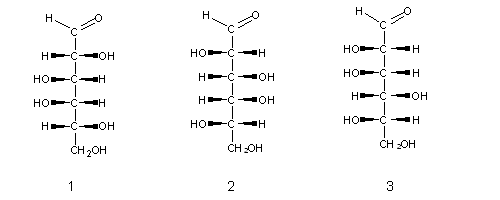
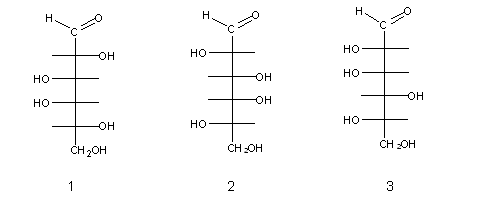
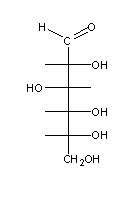
Os monossacarídeos naturais têm uma característica comum: quando escritos sob a forma de fórmulas de Fischer, o carbono assimétrico mais afastado do carbonilo contém o grupo OH no lado direito. Estes açúcares (como p.ex. o açúcar (1) acima) são chamados açúcares D- ( de direito), e os seus enantiómeros são de série L- (do latim levo, que significa esquerdo), como p.ex. os açúcares (2) e (3) acima.
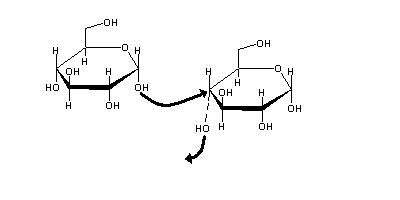
Os monossacarídeos podem converter-se em formas cíclicas, mediante o ataque do seu carbonilo por um dos seus grupos hidroxilo. Esta reacção é um exemplo relevante da formação de hemicetais em biologia. As formas cíclias só são estáveis se o anel tiver cinco ou mais lados (caso contrário os ângulos das ligações serão muito diferentes do valor ideal de ≈ 109o ). Na prática os açúcares mais comuns formam anéis de cinco lados (chamados furanoses) ou de seis lados (chamados piranoses). Em solução aquosa as formas cíclicas são frequentemente muito mais estáveis do que as formas lineares.
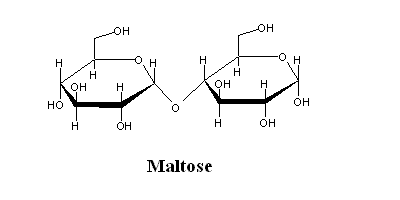
| (Glucose α-1,4 glucose) É o produto da degradação do amido pelas amilases. |
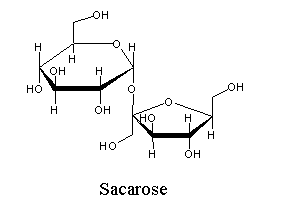
| (Glucose α-1 β-2 frutose) É o açúcar extraído da cana sacarina. |
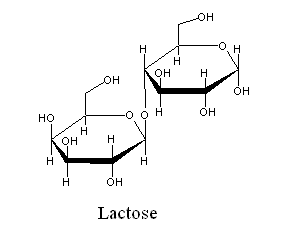
| (Galactose β-1,4 glucose) É o açúcar presente no leite. Na maior parte dos mamíferos, a enzima responsável pela sua hidrólise (a lactase) só é sintetizada durante o período de aleitamento. Na ausência de lactase, a lactose não pode ser digerida, tornando-se por isso uma fonte de alimento abundante para a flora intestinal (que então começa a crescer descontroladamente), e originando por isso náuseas e vómitos, assim como diarreia (por afectar a osmolaridade do intestino delgado). No entanto, desde a domesticação do gado, algumas populações humanas desenvolveram a capacidade de continuarem a sintetizar a lactase durante toda a vida. |
 |
Biochemistry, by Donald Voet & Judith Voet
Um excelente livro. Expõe a Bioquímica com referências constantes à química orgânica e à lógica bioquímica. A inspiração destas páginas.... Particularmente indicado a estudantes de Licenciaturas em Bioquímica, Ciências Farmacêuticas ou Química. |
 |
Biochemistry, Stryer
Um texto clássico, frequentemente actualizado e re-editado. |
 |
Textbook of Biochemistry with Clinical Correlations, Thomas Devlin Aconselhado a estudantes de licenciaturas em Medicina, Enfermagem, etc. Imensos exemplos da aplicação da bioquímica a casos clínicos |
 |
Principles of Biochemistry, Lehninger Um texto clássico, frequentemente actualizado e re-editado. |