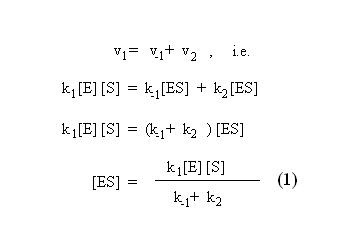
Professor Associado, Universidade Fernando Pessoa
| Outras vias metabólicas: | |||
| Química Orgânica: |
Existem moléculas biológicas capazes de aumentar bastante a velocidade de reacções químicas, i.e., são catalizadores. Estas moléculas são genericamente denominadas “enzimas”, e são (na sua quase totalidade) proteínas. As enzimas não proteicas conhecidas são constituídas por RNA. As enzimas são altamente específicas: cada enzima apenas reage com um conjunto muito restrito de moléculas (os seus “substratos”). As enzimas não alteram o equilíbrio químico das reacções catalizadas, apenas diminuem a sua energia de activação.
O mecanismo mais simples para explicar a acção enzimática é o modelo de Michaelis-Menten:
E +S ↔ ES → E + P
Neste modelo a enzima (E) liga-se ao substrato (S) para formar um complexo enzima-substrato (ES). Este pode separar-se novamente en enzima e substrato livre ou transformar o substrato em produto (P). Como em qualquer reacção elementar (i.e. uma reacção que ocorre por simples colisão entre reagentes), a velocidade de cada passo será proporcional à concentração dos reagentes desse passo. Em cada caso, a constante de proporcionalidade será uma função da energia de activação desse passo. Na maior parte das enzimas, verifica-se que o equilíbrio E +S ↔ ES se atinge muito rapidamente (em poucas dezenas de milissegundos). Uma vez atingido o equilíbrio, a concentração de ES mantém-se constante, uma vez que sempre que um complexo ES se dissocia em produto e enzima livre, esta se liga muito rapidamente a uma nova molécula de substrato, regenerando o ocmplexo ES. Nestas condições, é óbvio que a velocidade de degradação de ES é igual à velocidade da sua formação, ou seja:
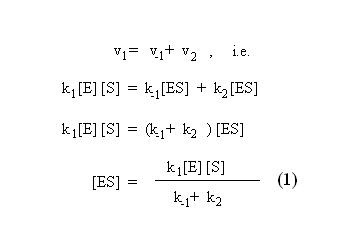
Em princípio, não nos é dado saber em cada momento qual a concentração de enzima que se encontra livre ou sob a forma de complexo enzima-substrato. No entanto, sabemos que a soma das duas concentrações deve igualar a concentração de enzima total (Et). Substituindo em (1)

Se o passo limitante da reacção fôr a transformação do complexo ES em enzima livre e produto, a velocidade da reacção enzimática será:

A expressão pode
ser simplificada se juntarmos todas as constantes presentes no
denominador numa nova constante:
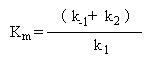 ,
que é conhecida como constante de Michaelis.
,
que é conhecida como constante de Michaelis.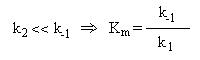 que é também a constante de dissociação
do complexo ES. Km é portanto uma medida da estabilidade do
complexo enzima-substrato. Substituindo na expressão (2), esta
toma assim a forma:
que é também a constante de dissociação
do complexo ES. Km é portanto uma medida da estabilidade do
complexo enzima-substrato. Substituindo na expressão (2), esta
toma assim a forma:

A velocidade máxima da reacção (Vmax) é obtida a concentrações infinitas de substrato:
 . Substituindo novamente, obtém-se a forma
familiar da equação de Michaelis-Menten:
. Substituindo novamente, obtém-se a forma
familiar da equação de Michaelis-Menten:

A representação gráfica da velocidade da reacção em função da concentração de substrato é portanto uma hipérbole. A assímptota horizontal corresponde à vmax. O valor de KM também pode ser obtido através do gráfico, uma vez que quando a [S]=KM , a equação de Michaelis-Menten prevê que a velocidade seja

A constante de Michaelis Menten é portanto a concentração de substrato para a qual a velocidade da reacção é metade da velocidade máxima.
O efeito de inibidores competitivos na actividade enzimática
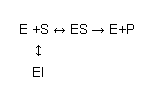
Um inibidor competitivo de uma enzima é uma molécula capaz de se ligar à enzima e impedir a ligação da mesma ao substrato. Para que isto aconteça é necessário que o inibidor se ligue ao local da enzima normalmente ocupado pelo substrato (este local denomina-se “centro activo”), o que obviamente só é possível quando o inibidor tem uma estrutura química bastante semelhante à do substrato.
Aplicando um tratamento matemático análogo ao utilizado anteriormente, prova-se que na presença de um inibidor competitivo, a velocidade da reacção enzimática é dada por: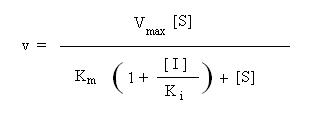
A comparação desta equação com a equação de Michaelis-Menten mostra que:
na presença de um inibidor competitivo, a velocidade da reacção é inferior à da reacção não inibida (daí o nome de “inibidor”).
A
concentração de substrato para a qual a velocidade é
metade da velocidade máxima é
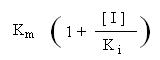 .
Este valor (chamemos-lhe KM aparente) é
sempre superior ao valor de KM na ausência do
inibidor.
.
Este valor (chamemos-lhe KM aparente) é
sempre superior ao valor de KM na ausência do
inibidor.
quando 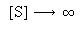 , a velocidade da reacção aproxima-se
assimptoticamente de vmax , tal como na reacção
não-inibida.
, a velocidade da reacção aproxima-se
assimptoticamente de vmax , tal como na reacção
não-inibida.
O efeito de inibidores não-competitivos na actividade enzimática
Um inibidor não-competitivo de uma reacção enzimática é uma substância que se liga à enzima num local diferente do centro activo e que, embora não impeça a ligação do substrato ao centro activo, impede a sua transformação em produto: a reacção só pode ocorrer após o substrato se desligar da enzima.
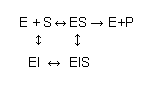
Aplicando um tratamento matemático análogo ao utilizado anteriormente, prova-se que na presença de um inibidor não-competitivo, a velocidade da reacção enzimática é dada por:
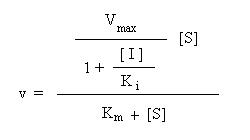
A comparação desta equação com a equação de Michaelis-Menten mostra que:
na presença de um inibidor não-competitivo, a velocidade da reacção é inferior à da reacção não inibida (daí o nome de “inibidor”).
A concentração de substrato para a qual a velocidade é metade da velocidade máxima é igual ao observado na ausência de inibidor.
quando
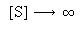 , a velocidade da reacção aproxima-se
assimptoticamente de
, a velocidade da reacção aproxima-se
assimptoticamente de
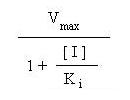 , que é sempre inferior ao da reacção
não-inibida.
, que é sempre inferior ao da reacção
não-inibida.
|
Biochemistry,
by Donald Voet & Judith Voet Um excelente livro. Expõe a Bioquímica com referências constantes à química orgânica e à lógica bioquímica. A inspiração destas páginas.... Particularmente indicado a estudantes de Licenciaturas em Bioquímica, Ciências Farmacêuticas ou Química. |
|
Biochemistry,
Stryer Um texto clássico, frequentemente actualizado e re-editado. |
|
Textbook
of Biochemistry with Clinical Correlations, Thomas Devlin Aconselhado a estudantes de licenciaturas em Medicina, Enfermagem, etc. Imensos exemplos da aplicação da bioquímica a casos clínicos |
|
Principles
of Biochemistry, Lehninger Um texto clássico, frequentemente actualizado e re-editado. |