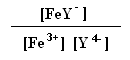
1. Descreva de que modo prepararia 5,000 L de carbonato de sódio 0,1000 M (105,99 g/mol) a partir do sólido (substância primária).
m Na2CO3 =nNa2CO3*MM(Na2CO3)
nNa2CO3=c * v
Substituindo:
m Na2CO3 = 0,1000 M *5,000 L * 105,99 g/mol = 53,00 g
2. Para calibração de um método fotométrico para a determinação de sódio é necessário prepara uma solução padrão de Na+ 0,0100 M . Descreva como prepararia 500,0 cm3 desta solução a partir do padrão primário Na2CO3.
cNa2CO3 = 1/2 cNa+
nNa2CO3=c * v
m Na2CO3 = nNa2CO3*MM(Na2CO3)
Substituindo:
m Na2CO3 = 1/2 * 0,0100 M *0,5000 L * 105,99 g/mol = 0,265 g
3. Como prepararia 50,00 mL de soluções padrão de Na+ 0,00500 M , 0,00200 M e 0,00100 M a partir da solução anterior?
ci vi = cf vf
Substituindo:
0,0100 M vi = 0,00500 M 50,00 mL
vi = 0,00500 M 50,00 mL / 0,0100 M = 25,0 mL
4. O teor em alumínio numa amostra pode ser determinado por precipitação como uma base e calcinação a Al2O3, que é pesado. Qual a massa de alumínio numa amostra com 0,2365 g de precipitado calcinado?
n Al2O3= mAl2O3 / MM(Al2O3)
Substituindo:
n Al2O3= 0,2385 / 101,961 = 2,339 mmol
nAl = 2 nAl2O3 = 4,678 mmol
mAl = nAl * MA(Al) = 4,678 mmol * 26,9815 g/mol = 0,1262 g
5. O conteúdo em cálcio numa amostra de urina pode ser determinado pelo seguinte procedimento:
1º – Precipitação do Ca2+, em meio alcalino, sob a forma de oxalato de cálcio (CaC2O4)
2º – Após lavagem do precipitado com água fria para remoção do oxalato livre, o sólido é dissolvido em ácido, formando-se Ca2+ e H2C2O4.
3º – O ácido oxálico dissolvido é aquecido a 60 ºC e titulado com uma solução padrão de permanganato de potássio até viragem para cor violeta (ponto final).
Supondo que na titulação de 5,00 mL de uma amostra de urina sujeita a este tratamento se gastou 16,17 mL da solução padrão de permanganato, calcule a concentração de cálcio na amostra de urina.
Dados: Para determinar a concentração rigorosa de permanganato de potássio procedeu-se do seguinte modo: dissolveram-se 0,3562 g de Na2C2O4 num balão volumétrico de 250,00 mL, e titulou-se 10 mL desta solução com a solução de KMnO4, tendo-se gasto um volume de 48,36 mL.
48,36 mL de KMnO4 titulam 10,00 mL de Na2C2O4
c Na2C2O4 = n Na2C2O4 / v
n Na2C2O4 = m Na2C2O4 / MM (Na2C2O4)
Substituindo, vem:
c Na2C2O4 = 0,3562 g /133,999 g/mol / 0,25000 L = 10,63 mM
E a quantidade de Na2C2O4 presente em 10,00 mL desta solução é:
10,00 mL * 10,63 mM = 1,063 *10-4 mol,
Portanto, se 1,063 *10-4 mol C2O42- titulam 48,35 mL de KMnO4, 16,17 mL de KMnO4 titulam
n C2O42- = 16,17 / 48,35 * 1,063* 10-4 = 3,556 *10 -5 mol,
Esta quantidade de C2O42- é equivalente à quantidade de Ca2+ presente em 5,00 mL da amostra, pelo que a concentração de Ca2+ nesta é:
[Ca2+] = 3,556 *10 -5 / 5,00 *10-3 L = 7,112 * 10 -3 M
6. Uma amostra de 0,4671 g contendo hidrogenocarbonato de sódio foi dissovida e titulada com 40,72 mL de uma solução padrão de HCl 0,1067 M. Sabendo que a reacção é
HCO3- + H+ -> H2O + CO2
calcule a percentagem de bicarbonato de sódio na amostra.
nHCO3- = n H+ = [H+] * vH+
Substituindo:
nHCO3- = 4,345 mmol
o que corresponde a uma massa de NaHCO3 =
4,345 mmol * MM(NaHCO3) = 4,345 mmol * 84,007 g/mol = 0,3650 g
A amostra dada é portanto:
0,3650 g / 0,4671 g = 78,14 % NaHCO3
7. O alumínio pode ser determinado por titulação com EDTA: Al3+ + H2Y2- -> AlY- + 2 H+. Uma amostra de 1,00 g contendo Al2O3 requer 20,50 mL de solução de EDTA. Sabendo que para titular 25,00 mL de uma solução 0,100 M de CaCl2 se gastou 30,00 mL de EDTA, calcule a percentagem de Al2O3 na amostra.
n EDTA = n Ca2+ = [Ca2+] * v Ca2+
Substituindo :
n EDTA = 0,100 M * 25,00 mL = 2,50 mmol
[EDTA] = nEDTA / vEDTA = 2,50 mmol / 30,00 mL = 0,0833 M
Para titular a amostra, são necessários 20,50 mL desta solução, i,e,:
nAl3+ = nEDTA = [EDTA] * vEDTA = 0,0833 M * 20,50 mL = 1,708 mmol,
o que corresponde a uma massa de Al2O3 :
m Al2O3 = n Al2O3 * MM(Al2O3 ) = ½ nAl3+ * MM(Al2O3 ) = ½ * 1,708 mmol * 101,961 g/mol = 87,09 mg
ou seja:
87,09 mg/1,00 g = 8,71 % de Al2O3 na amostra dada,
8. Uma amostra de 0,8040 g de um mineral de ferro foi dissolvida em ácido. Em seguida, reduziu-se todo o ferro à forma de Fe(II) e titulou-se com 47,22 mL de uma solução padrão de KMnO4 0,02242 M. Calcule os resultados desta análise em termos de % de Fe (55,847 g/mol), e %de Fe3O4 (231,54 g/mol). A reacção do analito com o reagente titulante descreve-se pela seguinte equação:
MnO4- + 8 H+ + 5 Fe2+ → Mn2+ + 5 Fe3+ + 4 H2O
nFe2+ = 5* nMnO4- = 5* [MnO4-] * vMnO4-
nFe2+= 5* 0,02242 M * 47,22 mL = 5,293 mmol
i,e,:
mFe = 5,293 mmol * MA(Fe) = 5,293 mmol * 55,847 g/mol = 295,6 mg ,i,e, 36,77 % da amostra
mFe3O4= 5,293 mmol * MM(Fe3O4) = 5,293 mmol /3 * 231,54 = 408,5 mg ,i,e, 50,81 % da amostra
9. O monóxido de carbono contido em 20,30 mL de uma amostra de gás foi convertido em CO2 fazendo o gás passar por um leito de pentóxido de iodo aquecido (150 ºC)
I2O5 (s) + 5 CO(g) -> 5 CO2 (g) + I2(g)
O iodo destilado a esta temperatura é recolhido num absorvente que continha 8,25 mL de Na2S2O32- 0,01101 M.
I2 + 2 S2O32- -> 2 I- + S4O62-
O excesso de Na2S2O3 titula-se por retorno com 2,16 mL de uma solução 0,0947 M de I2. Calcule a massa de CO por litro de amostra.
nCO = 5* nI2 produzido
nI2 produzido = ½ n S2O32- gasto na titulação
n S2O32- gasto na titulação = n S2O32- inicial - n S2O32- final
n S2O32- inicial = [S2O32-] * vS2O32- = 0,01101 M * 8,25 mL = 90,8 mmol
n S2O32- final = 2* nI2 necessário para o titular = 2* [I2] vI2 = 2* 0,00947 M * 2,16 mL = 20,46 mmol
Portanto:
nCO = 5* ½ n S2O32- gasto na titulação = 5* ½ (90,8 mmol - 20,46 mmol) = 176 mmol
mCO = 176 mmol* 28,01 g/mol = 4,93 mg
Por litro de amostra gasosa:
[CO]= 4,93 mg/20,30 mL =243 mg/L
10. Que volume de Ba(OH)2 (0.80 mol/L) é necessário adicionar a 50 mL de NaOH 0,30 M para obter uma solução 0,50 M em HO- ?
2* nBa(OH)2 + nNaOH / vtotal = 0,50 M
Supondo que os volumes são aditivos, vtotal = vBa(OH)2 + vNaOH, Portanto:
2* [Ba(OH)2] * vBa(OH)2 + [NaOH] * vNaOH / (vBa(OH)2 + vNaOH) =0,50 M
0,80 M * vBa(OH) 2 + 0,30 M * 50 mL / (vBa(OH)2 + 50 mL) =0,50 M
0,80 M * vBa(OH) 2 + 15 mmol =0,50 M * vBa(OH)2 + 25 mmol
0,30 M * vBa(OH) 2 = 10 mmol
vBa(OH) 2 = 33 mL
11 Titularam-se 20,00 mL de uma solução de HCl 0,1000 M com uma solução de NaOH 0,1000 M. Calcule
11.1 o volume equivalente, e o pH da solução no ponto de equivalência.
No ponto de equivalência,
nHO- adicionado = nH+ presente inicialmente
[HO-] vHO- = [H+] vH+
0,1000 M vHO- = 0,1000 M * 25,00 mL
vHO- = 25,00 mL
pH no ponto de equivalência =7,0, uma vez que na titulação de ácido forte com base forte não se produz nenhuma partícula ácido/base com características diferentes do solvente, e portanto o pH é o pH do solvente puro,
Nota: Rigorosamente, o catião Na+ em solução aquosa é um ácido fraco, mas dado o seu elevado pKa (≈14,5) e baixa concentração (0,100 M) em relação à água (55,5 M), não afectará o pH da solução.
11.2 a variação de pH entre 1% antes e 1% depois do ponto de equivalência
1% antes do volume equivalente:
n H+ restante= 1% n H+ inicial = 1% 0,100 M 25,00 mL = 25 mmol
Volume da solução = vH+ + vHO- = 25,00 mL + 99 % 25,00 mL= 49,75 mL
[H+] = 25 mmol / 49,75 mL = 5,025 * 10-4 M
pH = -log [H+] = 3,3
1% depois do volume equivalente:
n HO- restante= 1% n H+ inicial = 1% 0,100 M 25,00 mL = 25 mmol
Volume da solução = vH+ + vHO- = 25,00 mL + 101 % 25,00 mL= 50,25 mL
[HO-] = 25 mmol / 50,25 mL = 4,975 * 10-4 M
pHO = -log [HO-] = 3,3
pH =14 – pOH = 10,7
12.Titularam-se 20,00 mL de uma solução de ácido acético 0,1000 M com NaOH 5,000 * 10-2 M. Calcule:
12.1 o volume equivalente de NaOH
No ponto de equivalência,
nHO- adicionado = nCH3COOH presente inicialmente
[HO-] vHO- = [CH3COOH] vCH3COOH
0,05000 M vHO- = 0,1000 M * 20,00 mL
vHO- = 40,00 mL
12.2 o pH no início da titulação, no ponto de equivalência, 1% antes e 1% depois do ponto de equivalência e após a adição de 50,00 mL de NaOH.
No início da titulação, temos uma solução de ácido fraco
pH = 1/2 pKa -1/2 log [CH3COOH]
pH = 1/2 *4,76 -1/2 (-1)
pH =2,88
No ponto de equivalência, temos uma solução de base fraca:
pH = 7,00 +1/2 pKa +1/2 log [CH3COO-]
pH = 7,00 + 2,38 +1/2 log (0,0333)
pH = 8,64
1% antes ponto de equivalência:
pH = pKa + log ([CH3COO-]/[CH3COOH]
pH= 4,76 + log 99
pH = 6,76
1% depois do ponto de equivalência, o excesso de NaHO equivale a 0,02 mmol, num volume de 60,40 mL,
[HO-]= 0,02 mmol/60,40 mL = 3,31 * 10-4 M
pH = 14 - pOH =10,52
Após grande excesso (50,00 mL) de titulante, o excesso de NaOH é:
(50,00-40,00) *5,000* 10-2 M = 5,000 * 10-4 mol, num volume de 50,00+20,00 = 70,00 mL,
[HO-]= 0,5000 mmol / 70,00 mL = 7,14 * 10-3 M
pH = 14 - pOH =11,85
Os exercícios 13. a 16. resolvem-se de forma idêntica:
13.Titularam-se 25,00 mL de uma solução de ácido fórmico 0,1200 M com NaOH 0,1000 M. Calcule:
13.1 o volume equivalente de NaOH
13.2 o pH no início da titulação, no ponto de equivalência, 1% antes e 1% depois do ponto de equivalência e após a adição de 50,00 mL de NaOH.
14.Titularam-se 50,00 mL de NaCN 0,0500 M com HCl 0,1000 M. Calcule o pH depois da adição de 0.00 , 10.00, 25.00 e 26.00 mL de ácido.
15.Trace a curva de titulação de 10,00 mL de uma solução aquosa de ácido sulfúrico 0,1500 M com uma solução de NaOH 0,3000 M.
16. Esboce as seguintes curvas de titulação:
16.1 20,00 mL de amoníaco 0,1000 M com ácido clorídrico 0,1000 M.
16.2 25,00 mL de ácido maleico 0,1000 M com hidróxido de sódio 0,1000 M.
16.3 20,00 mL de fosfato de sódio 0,1000 M com ácido clorídrico 0,1000 M.
17.Analisou-se uma amostra de 0,7121 g de farinha de trigo pelo método de Kjeldahl:
CaHbNc -----> a CO2 + ½ b H2O + ½ c (NH4)2SO4 (reacção realizada na presença de H2SO4 como catalizador)
(NH4)2SO4 + OH- ---> 2 NH3 + SO42-
NH3 + HCl --> NH4Cl + HClexcesso
HClexcesso + NaOH -->H2O + NaCl
O amoníaco formado por adição de uma base concentrada após digestão com H2SO4 foi destilado sobre 25,00 mL de HCl 0,04977 M. O excesso de HCl foi depois titulado por retorno com 3,97 mL de NaOH 0,04012 M. Calcule a percentagem de proteína na farinha.
Dados: 17,5% de N na proteína da farinha.
nHCl total = [HCl] vHCl = 0,04977 M * 25,00 mL = 1,244 mmol = nHCl gasto na reacção com o NH3 + nHClexcesso
nHClexcesso= nNaOH necessário para o titular = 3,97 mL * 0,04012 M = 0,1593 mmol
nNproteína = nNH3 formado = nHCl total – nHClexcesso = 1,244 mmol – 0,1593 mmol =1,085 mmol
mNproteína = 15,20 mg
mproteína = 15,20 mg/0,175 = 86,9 mg
A percentagem de proteína na farinha é portanto = 0,0869 g/ 0,7121 g = 12,2 %
18. Determine o título rigoroso de uma solução aquosa de HCl 0,04 M, sabendo que quando se titulam 50,00 mL do ácido se gastam 50,00 mL de uma solução preparada a partir de 0,3850 g de bórax (381,37 g/mol).
Na2[B4O5(HO)4]. 8H2O <-> 2 H3BO3 + 2 [B(HO)4]- + 2 Na+ + 3 H2O
[B(HO)4]- + H+ <-> H3BO3 + H2O
nbórax= mbórax/MM(bórax) = 0,3850 g / 381,37 g/mol = 1,0095 mmol
nHCl = 2* nbórax= 20,19 mmol
[HCl] = nHCl / vHCl =2,019 mmol / 50,00 mL = 0,04038 M
19. Uma solução de NaOH isenata de carbonatos tinha uma concentração 0,05118 M imediatamente depois de preparada. Exactamente 1,000 L desta solução foi exposto ao ar durante algum tempo e absorveu 0,1962 g de CO2. Calcule o erro relativo que terá lugar ao titular uma solução de ácido acético com esta solução contaminada,utilizando a fenolftaleína como indicador.
nCO2 = 0,1962 g / 44,010 g/mol = 4,458 mmol
nNaOHinicial= 1,000 L* 0,05118 M = 51,18 mmol
O ácido carbónico é diprótico, e reage por isso com o dobro da sua quantidade de NaOH,
[NaOH]final= nNaOHfinal / vNaOH = 51,18mmol – 2* 4,458 mmol /1,000 L = 0,04226 M,
O erro na titulação será 0,05118 / 0,04226 = 21,11%,
20. Calcula a variação de pAg, entre 1% antes e 1% depois do ponto de equivalência, na titulação de 25,00 mL de uma solução de nitrato de prata 0,1000 M com uma solução equimolar de cloreto de sódio.
nAgNO3= [AgNO3] * vAgNO3
nAgNO3= 0,1000 M* 25,00 mL = 2,500 mmol
No ponto de equivalência, nNaCladicionado= nAgNO3inicial=2,500 mmol :
vNaCl=nNaCl/[NaCl]= 2,500 mmol/ 0,1000 M = 25,00 mL
1% antes ponto de equivalência:
nAg+= 1 % nAgNO3 inicial = 0,02500 mmol
v= 25,00 mL + 99% 25,00 mL = 49,75 mL
[Ag+]=0,02500 mmol/ 49,75 mL = 5,02 * 10-4 M
pAg = -log [Ag+]= -log 5,02 * 10-4 = 3,30
1% depois do ponto de equivalência, o excesso de NaCl equivale a 0,02500 mmol, num volume de 50,25 mL,
[Cl-]= 0,02500 mmol/50,25 mL = 4,98 * 10-4 M
Dado que o Kps(AgCl)= 1,8*10 -10, a concentração máxima de Ag+ possível na solução é:
[Ag+]= Kps(AgCl)/ [Cl-]= 1,8*10 -10/4,98 * 10-4 = 3,64* 10-7 M
pAg= 6,44
21. Determinou-se o teor em cloreto numa solução salina pelo método de Volhard. Uma alíquota de 10,00 mL foi tratada com 15,00 mL de uma solução padrão de AgNO3 0,1182 M. O excesso de prata foi titulado com uma solução padrão de KSCN 0,101 M, sendo necessário 2,38 mL para atingir o ponto de equivalência de Fe(SCN)2+. Calcule a concentração de cloreto na solução salina, em g/L.
nAg+excesso = nSCN-adicionda= vSCN- *[SCN-] = 2,38 mL *0,101 M = 0,2404 mmol
nAg+inicial = vAgNO3 *[ AgNO3] = 15,00 mL * 0,1182 M = 1,773 mmol
nCl-= nAg+gasto = nAg+inicial - nAg+excesso =1,773 mmol - 0,2404 mmol = 1,533 mmol
[Cl-] = 1,533 mmol / 10,00 mL = 0,1533 M
22. Titulou-se 25,00 mL de uma solução contendo 0,0311 M de Na2C2O4 com La(ClO4)3 0,0257 M, havendo a precipitação de oxalato de lantânio:
2 La3+ + 3 C2O42- -> La2(C2O4)3
22.1 Qual o volume de perclorato de lantânio necessário para atingir o ponto de equivalência?
nLa3+ = 2/3 nC2O42- = 2/3 [C2O42-] vC2O42- = 2/3 * 25,00 mL * 0,0311 M = 0,5183 mmol
vLa3+ = nLa3+ / [La3+] = 0,5183 mmol / 0,0257 M = 20,17 mL
22.2 Qual o pLa3+ quando se adicionaram 10,00 mL de La(ClO4)3 ?
Em qualquer momento da titulação antes do ponto de equivalência,
nC2O42- = nC2O42-inicial - nC2O42-precipitado = nC2O42-inicial - 3/2 n La3+ adicionado
Após a adição de 10,00 mL de La(ClO4)3
nC2O42- = 25,00 mL * 0,0311 M - 3/2 10,00 mL * 0,0257 M = 0,7775 mmol – 0,3855 mmol = 0,392 mmol
Como v=25,00 mL + 10,00 mL =35,00 mL , [C2O42-] = 0,392 mmol/35,00 mL =0,0112 M.
A quantidade de La3+ em solução é obtida através do produto de solubilidade do La2(C2O4)3:
Kps= [La3+] 2 [C2O42-]3
1,03 * 10-25 = [La3+] 2 (0,0112)3
[La3+]= 2.71 * 10-10 M
pLa3+ = -log [La3+] = 9.567
22.3 Determine o pLa3+ no ponto de equivalência.
No ponto de equivalência, a precipitação é quantitativa. Pode-se considerar que o La2(C2O4)3 em solução é o proveniente da dissolução do precipitado formado.
Kps= [La3+] 2 [C2O42-]3
Como C2O42-= 3/2 nLa3+, a expressão acima pode ser escrita :
1,03 * 10-25 = [La3+] 2 [3/2 La3+] 3
1,03 * 10-25 = [La3+] 2 [3/2 La3+] 3
1,03 * 10-25 = [La3+] 2 (3/2)3 [La3+] 3
[La3+]5=1,03 * 10-25 / (3/2)3
[La3+]5= 3,052 *10-26
[La3+]= 7,89 *10-6 M
pLa3+ = -log [La3+] = 5.103
22.4 Calcule o pLa3+ após a adição de 25,00 mL de La(ClO4)3
Após a adição de 25,00 mL de La(ClO4)3 já foi ultrapassado o ponto de equivalência. Portanto
nLa3+livre= nLa3+adicionado –nLa3+precipitado= nLa3+adicionado – 2/3 nC2O42- inicial
nLa3+livre= 25,00 mL * 0,0257 M – 2/3 0,7775 mmol = 0,1242 mmol
[La3+] = nLa3+livre /vtotal = 0,1242 mmol / (25,00 mL+25,00 mL) = 2,483 *10-3 M
pLa3+ = -log [La3+] = 2.605
23. 40,00 mL de uma mistura contendo 0,0502 KI e 0,0500 M de KCl foram titulados com AgNO3 0,0845 M.
23.1 Calcule a concentração de Ag+ no ponto de equivalência correspondente à titulação do iodeto em separado.
O AgI em solução no ponto de equivalência é o proveniente da dissolução do precipitado formado. Se a nossa solução não contiver o AgCl, e devido à estequiometria do sal, nAg+=nI- Portanto:
Kps= [Ag+][I-] =[Ag+][Ag+]
1,5* 10-16= [Ag+]2
[Ag+]=1,2*10-8 M
23.2 Demonstre que para a concentração de Ag+calculada no ponto anterior ocorre precipitação de Cl-.
Kps(AgCl)= 1,8 *10-10
Se o quociente da reacção for superior ao Kps, observar-se-á precipitação. È portanto conhecer a concentração de Cl-, que é diferente da inicial ( 0,0500 M) devido à variação de volume provocada pela adição de AgNO3 até à completa precipitação do I- : Este volume é calculado da seguinte forma.
No ponto de equivalência,
nAg+=nI-
vAg+ [Ag+] = vI- [I-]
vAg+ 0,0845 M = 40,00 mL 0,0502 M
vAg+ = 40,00 mL 0,0502 M = 23,76 mL
vtotal= 40,00 mL + 23,76 mL = 63,76 mL
e a concentração de Cl- será dada por:
civi=cfvf
0,0500 M * 40,00 mL= cf 63,76 mL
cf = 0,0314 M
Neste momento o quociente da reacção será [Ag+][Cl-] = 1,2*10-8 *0,0314 = 3,76*10-10 > Kps(AgCl). Logo ocorre precipitação de Cl-.
24 Qual o volume mínimo de nitrato de prata 0,09621 M necessário para assegurar que haja um excesso de iões prata na titulação de
24.1 uma amostra impura de NaCl com uma massa de 0,2513 g?
A quantidade máxima de Cl- possivelmente presente na amostra é:
nCl-= nNaCl= mNaCl/MM(NaCl) =0,2513g/58,443= 4,300 mmol
E o volume necessário para a titular é:
vAgNO3 = nAgNO3 / [AgNO3] = 4,300 *10-3 / 0,09621 M = 44,69 mL
24.2 uma amostra de 0,3462 g que contém 74,52 % (p/p) de ZnCl2?
A quantidade de Cl- presente na amostra é:
nCl-= 2*nZnCl2=2* mZnCl2/MM(ZnCl2) =2* 0,7452 * 0,3462/136,29= 3,786 mmol
Eo o volume necessário para a titular é:
vAgNO3 = nAgNO3 / [AgNO3] = 3,786 *10-3 / 0,09621 M = 39,35 mL
24.3 25,00 mL de AlCl3 0,01907 M?
A quantidade de Cl- presente na amostra é:
nCl-= 3*nAlCl3= 3* vAlCl3 [AlCl3] =3* 25,00 mL * 0,01907 M= 1,430 mmol
Eo o volume necessário para a titular é:
vAgNO3 = nAgNO3 / [AgNO3] = 1,430*10-3 / 0,09621 M = 14,87 mL
25. Na titulação, pelo método de Fajans, de uma amostra de 0,7908 g gastaram-se 45,32 mL de nitrato de prata 0,1046 M.
nCl-= nAg+ = nAgNO3 = [AgNO3] vAgNO3 = 0,1046 M * 45,32 mL = 4,740 mmol
25.1 Expresse os resultados como percentagem de Cl-
mCl- = 4,740 mmol * MM(Cl-) = 4,740 mmol * 35,453 =0,1681 g
A amostra tem 0,1681/0,7908 = 21,25 % Cl-
25.2 Expresse os resultados como percentagem de BaCl2∙2H2O
mBaCl2∙2H2O= nBaCl2∙2H2O * MM(BaCl2∙2H2O) = ½ * nCl-* MM(BaCl2∙2H2O) = ½ * 4,740 mmol * 244,27 = 0,5789 g
A amostra seria 0,5789 g/ 0,7908 g = 73,21 % BaCl2∙2H2O
25.3 Expresse os resultados como percentagem de ZnCl2∙2NH4Cl
mZnCl2∙2NH4Cl= nZnCl2∙2NH4Cl * MM(ZnCl2∙2NH4Cl) = 1/4 * nCl-* MM(ZnCl2∙2NH4Cl) = 1/4 * 4,740 mmol * 243,28 = 0,2883 g
A amostra seria 0,2883 g/ 0,7908 g = 36,46 % ZnCl2∙2NH4Cl
26. O crómio (III) reage lentamente com o EDTA, sendo por isso determinado recorrendo a uma titulação de retorno. Uma preparação farmacêutica contendo crómio(III) foi analisada por tratamento de 2,63 g de amostra com 5,00 mL de 0,0103 M de EDTA . A quantidade de EDTA que não reagiu foi titulada com 1,32 mL de solução de zinco 0,0122 M. Qual a percentagem de crómio na preparação farmacêutica?
nEDTAtotal= 5,00 mL * 0,0103 M = 5,15 * 10-5 mol
nEDTAexcesso = nZn2+necessário para a titular = 1,32 mL * 0,0122 M = 1,61 * 10-5 mol
nCr3+= nEDTAtotal - nEDTAexcesso = 5,15 * 10-5 – 1,61 * 10-5 = 3,54 * 10-5 mol
mCr3+ = nCr3+ * MM(Cr3+)= 3,54 * 10-5* 51,996 = 1,84 * 10-3 g
A percentagem de Cr3+ na preparação será 1,84 * 10-3 g/ 2,63 =0,0700 %
27. A constante de formação do complexo de Fe(III) com EDTA é 1,3*1025. Calcule as concentrações de Fe3+ livre numa solução de FeY- 0,10 M a pH 4,00 e pH 1,00. (αY4- a pH 1,00 = 1,9 *10-18 ; αY4- a pH 4,00 = 3,8 *10-9)
1,3*1025=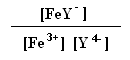
1,3*1025=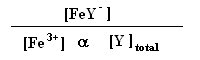
Como nYtotal = nFe3+, isto significa que
1,3*1025 =
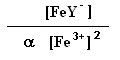
e portanto:
[Fe3+]2 = 0,10 M / a 1,3*1025
A pH = 1,0 [Fe3+] = 6,36 * 10-5
A pH = 4,0 [Fe3+] = 1,43 * 10-9
28. Uma amostra de 25,00 mL com uma concentração desconhecida de Fe3+ e Cu2+ necessitou de 16,06 mL de EDTA 0,05083 M para a titulação completa. Um volume de 50,00 mL da mesma amostra foi tratado com NH4F para proteger o Fe3+ . Em seguida, o Cu2+ foi reduzido e mascarado pela adição de tioureia. Após adição de 25,00 mL de EDTA 0,05083 M, o Fe3+ foi libertado do complexo com o fluoreto, formando-se um complexo com o EDTA. O excesso de EDTA consumiu 19,77 mL de Pb2+ 0,01833 M para atingir o ponto de equivalência (usando o alaranjado de xilenol como indicador). Calcule a concentração de Cu2+ na amostra.
nFe3+ + nCu2+ = nEDTA = vEDTA [EDTA] = 16,06 mL * 0,05083 M = 8,163 *10-4 mol
Como o volume de solução contendo os dois catiões é 25,00 mL, isto dá-nos
[Fe3+] + [Cu2+ ] = 8,163 *10-4 mol / 25,00 mL = 3,265 *10-2 M
Para a titulação por retorno do Fe3+ em 50,00 mL de solução , utilizou-se:
nEDTAinicial = 25,00 mL * 0,05083 M = 1,2708 *10-3 mol
nEDTAexcesso = n Pb2+ = 19,77 mL * 0,01883 M = 3,723 *10-4
nFe3+ = nEDTAinicial - nEDTAexcesso = 1,2708 *10-3 - 3,723 *10-4= 8,985 *10-4 mol
[Fe3+] = 8,985 *10-4 mol / 50,00 mL = 1,797 *10-2 M
E portanto [Cu2+ ]= 3,265 *10-2 -1,797 *10-2 =1,468 *10-2 M
29. O ião Mn+ (100,0 mL do ião metálico 0,0500 M tamponados a pH 9,00) foi titulado com EDTA 0,0500 M.
29.1 Qual o volume equivalente (Ve)?
nEDTA=nMn+
vEDTA [EDTA]= vMn+ [Mn+]
vEDTA 0,0500 M = 100,00 mL 0,0500 M
vEDTA = 100,00 mL
29.2 Calcule a concentração de Mn+ quando V= ½ Ve
V= ½ * Ve = 50,00 mL
Vtotal = 100,00 + 50,00 =150,00 mL
nMn+ = nMn+inicial - nEDTAadicionado = 100,00 mL 0,0500 M - 50,00 mL 0,0500 M = 2,50 mmol
[Mn+] = 2,50 mmol / 150,00 mL = 0,0167 M
29.3 Sabendo que a fracção de EDTA livre que está na forma Y4- (αY4-)a pH 9,00 é 0.054, e que a constante de formação (Kf ) é 1012,00 , calcule a constante de formação condicional K'f
Kf = [MY4-n] / [Mn+] [Y4-] = 1012,00
[Y4-] = a [EDTA] ó [Y4-] = a [EDTA]
Substituindo, vem:
[MY4-n] / [Mn+] a [EDTA] =1012,00
[MY4-n] / [Mn+] 0,054 [EDTA] =1012,00
[MY4-n] / [Mn+] [EDTA] = Kf’=1012,00 * 0,054 = 5,4 *1011
29.4 Calcule a concentração de Mn+ quando V= Ve
[MY4-n] / [Mn+] [Y4-] =
[MY4-n] / [Mn+] a [EDTA] =
[MY4-n] / [Mn+] 0,054 [EDTA]
Como nEDTA=nMn+a expressão pode ser simplificada:
1012,00 = [MY4-n] / [Mn+]2 0,054
nMY4-n = nMn+inicial = 5,00 mmol. Vtotal = 100,00 + 100,00 =200,00 mL, portanto
[MY4-n] = 5,00 mmol/ 200,00 mL = 2,5 *10-2 M. Substituindo:
[Mn+]2 = [MY4-n] / 1012,00 0,054 = 2,5 *10-2 M / 1012,00 0,054
[Mn+]= 2,15 *10-7 M
29.5 Calcule a concentração de Mn+ quando V= 1,100 Ve
1012,00=[MY4-n] / [Mn+] 0,054 [EDTA]
nEDTA = nEDTAadicionado - nMn+inicial = 5,50 mmol – 5,00 mmol = 0,50 mmol, portanto como Vtotal = 210,00 mL :
[EDTA]= 2,38*10-3 M
nMY4-n = 5,00 mmol, logo [MY4-n]= 2,38*10-2 M. Substituindo na expressão acima:
1012,00=2,38*10-2 / [Mn+] 0,054 2,38*10-3
[Mn+]= 1,85*10-11M
30. O ião cálcio foi titulado com EDTA a pH 11, usando calmagite como indicador.
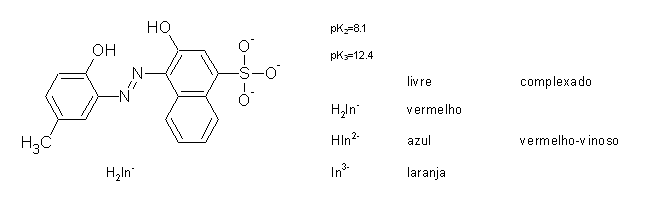
Qual é a principal espécie de calmagite a pH 11? Qual é a cor que se observa antes e depois do ponto de equivalência?
pH = pKa2 + log [HIn2-] / [H2In-]
pH = pKa3 + log [In3-] / [HIn2-]
Substituido os valores do pH e dos pK :
11 = 8,1 + log [HIn2-] / [H2In-] ó [HIn2-] = 794 [H2In-]
11 = 12,4 + log [In3-] / [HIn2-] ó [HIn2-] = 25 [In3-]
A espécie predominante é HIn2-. Antes do ponto de equivalência a solução é azul, e depois é vermelho-vinho.
31. Um volume de amostra de 1,000 mL contendo uma quantidade desconhecida de Co2+ e Ni2+ foi tratado com 25,00 mL de EDTA 0,03872 M. Na titulação de retorno, gastou-se 23,54 mL de uma solução padrão de Zn2+ 0,02127 M (a pH 5) para atingir o ponto final do alaranjado de metilo. Simultaneamente, fez-se passar 2,000 mL da amostra por uma coluna de troca iónica (que retarda mais o Co2+ que o Ni2+). O Ni2+ que passou pela coluna foi tratado com 25,00 mL de EDTA 0,03872 M e necessitou de 25,63 mL de Zn2+ 0,02127 M para a retrotitulação. O Co2+, que emergiu mais tarde da coluna, foi também tratado com 25,00 mL de EDTA 0,03872 M. Quantos mL de solução padrão de Zn2+ 0,02127 M foram necessários apra a retrotitulação?
Titulação de 1,0000 mL de amostra:
nEDTAtotal = 25,00 mL * 0,03872 M = 0,9680 mmol
nEDTAexcesso = nZn2+ = 23,54 mL * 0,02127 M = 0,5007 mmol
nCo2+ +nNi2+ = nEDTAtotal - nEDTAexcesso = 0,4637 mmol
[Co2+] + [Ni2+] = 0,4637 mmol / 1,000 mL = 0,4637 M
Titulação do Ni2+ contido em 2,000 mL
nEDTAtotal= 25,00 mL * 0,03872 M = 0,9680 mmol
nEDTAexcesso = nZn2+ = 25,63 mL* 0,02127 M = 0,5451 mmol
nNi2+ = nEDTAtotal - nEDTAexcesso = 0,4228 mmol
[Ni2+]= 0,4228 mmol / 2,000 mL = 0,2114 M
Daqui se conclui que [Co2+] = 0,4637 M - 0,2114 M = 0,2523 M
Titulação do Co2+ contido em 2,000 mL
nEDTAtotal= 25,00 mL * 0,03872 M = 0,9680 mmol
nEDTAque reagiu = nCo2+ = 0,2523 M * 2,000 mL = 0,5046 mmol
nEDTAexcesso= nEDTAtotal - nEDTAque reagiu = 0,9680 mmol- 0,5046 mmol = 0,4634 mmol
vZn2+= nZn2+/ [Zn2+] = nEDTAexcesso / [Zn2+]= 0,4634 mmol / 0.02127 M = 21,79 mL
32.O ião sulfureto foi determinado por titulação indirecta com EDTA: a uma mistura contenfo 25,00 mL de Cu(ClO4)2 0,04332 M e 15 mL de tampão acetato (pH 4,5), adicionou-se 25,00 mL de solução de sulfureto e agitou-se vigorosamente. O precipitado CuS foi filtrado e lavado com água quente. Em seguida, adicionou-se amoníaco ao filtrado (que continha um excesso de Cu2+ ) até ao aparecimento da cor azul do complexo Cu(NH3)42+. Na titulação com uma solução de EDTA 0,03927 M gastou-se um volume de 12,11 mL para atingir o ponto final da murexida. Calcule a concentração de sulfureto na amostra.
nCu2+excesso=nEDTA = 12,11 mL* 0,03927 M = 0,47556 mmol
nCu2+inicial= 25,00 mL * 0,04332 M = 1,083 mmol
nS2-= nCu2+inicial – nCu2+excesso= 0,6074 mmol
[S2-]= 0,6074 mmol / 25,00 mL = 0,02430 M
33. Considere a titulação de 100,0 mL de Fe2+ 0,0500 M com Ce4+ 0,100 M. Calcule:
33.1 o volume equivalente
Fe2++ Ce4+ → Fe3++ Ce3+
nFe2+ = nCe4+
100,0 mL * 0,0500 M = vCe4+ * 0,100 M
vCe4+ = 50,0 mL
33.2 a diferença de potencial quando o volume de titulante adicionado for de 10.00, 25.00, 36.00, 50.00, 63.00 e 100.0 mL.
Uma vez que os potenciais dos pares Fe3+/Fe2+ (0,77 V) e Ce4+/Ce3+ (1,61 V) são bastante afastados o potencial pode ser calculado com exactidão considerando apenas o par presente em grande quantidade (i.e. opar do titulado antes do ponto de equivalência, e o par do titulante após este ponto). No ponto de equivalência, o potencial será a média dos potenciais dos pares envolvidos.
Assim, antes do ponto de equivalência teremos:
E= E0Fe3+/Fe2+ + RT/nF ln ([Fe3+]/[Fe2+])
E= E0Fe3+/Fe2+ + RT/nF ln (nFe3+/nFe2+)
E= E0Fe3+/Fe2+ + RT/nF ln (nCe4+adicionado/ (nFe2+inicial- nCe4+adicionado))
E depois do ponto de equivalência teremos:
E= E0Ce4+/Ce3+ + RT/nF ln ([Ce4+]/[Ce3+])
E= E0Ce4+/Ce3+ + RT/nF ln (nCe4+ / nCe3+)
E= E0Ce4+/Ce3+ + RT/nF ln (nCe4+adicionado – nFe2+inicial / nFe2+inicial)
Os potenciais serão:
|
Vtitulante adicionado (mL) |
E (V) |
|
10,00 |
0,73 |
|
25,00 |
0,77 |
|
36,00 |
0,79 |
|
50,00 |
1,19 |
|
63,00 |
1,58 |
|
100,00 |
1,61 |
34. a 36. resolvem-se de forma idêntica ao anterior.
34. Considere a titulação de 50,00 mL de I- 1,00 mM com Br2 5,00 mM para dar I2 e Br-. Calcule o potencial (contra o eléctrodo saturado de calomelanos) para os seguintes volumes de Br2: 0.100, 2.50, 4.99, 5.01 e 6.00 mL.
35. Calcule o potencial no ponto de equivalência da titulação de 100 mL de Fe2+ 0,100 M em H2SO4 0,500 M com 100 mL de MnO4- 0,0200 M.
36. Calcule o potencial (vs. ENH) de uma mistura quando 5,0 mL de uma solução de Ce4+ 0,10 M são adicionados a 5,0 mL de Fe2+ 0,30 M.
37. Seria o tetrassulfonato de indigo um indicador redox apropriado para a titulação de Fe(CN)64- com Tl3+ em HCl 1M?
Eº [Fe(CN)3- /Fe(CN)64- ] = 0,356 V Eº indicador = 0,36 V Eº (Tl3+/Tl+) = 0,77V
O potencial no ponto de equivalência é a média ponderada dos potenciais dos pares envolvidos, i.e. = (2*0,77+0,356) /3 = 0,60 V.
Para que um indicador se possa usar, convém que o seu ponto de viragem se dê próximo do volume equivalente (ou seja, com um erro máximo de 1%).
1% antes do ponto de equivalência (i.e., depois de adicionar 99% do titulante necessário), o potencial da solução será:
E= 0,356 + RT/nF ln (99/1) = 0,474 V
1% depois do volume de equivalência, o potencial da solução será
E= 0,77 + RT/nF ln (1/100) = 0,71 V (notar que neste caso n=2)
O indicador não é apropriado, uma vez que o seu potencial (0,36 V) não se encontra dentro do intervalo de potencial [0,474 V;0,71 V].
38. Uma solução de triiodeto foi padronizada com óxido de arsénio (As4O6, 395,683 g/mol). A titulação de 25,00 mL de uma solução preparada por dissolução de 0,3663g de As4O6 num volume de 100,0 mL necessitou de 31,77 mL de I3-.
As4O6 + 6 H2O --> 4 H3AsO3
H3AsO3 + I3- + H2O --> H3AsO4 + 3 I- + 2 H+
38.1 Calcule a molaridade da solução de I3-
MM(As4O6)=395,6828 g.mol-1
[As4O6]= 0,3663 g / 395,6828 g.mol-1 / 100,00 mL = 9,257 *10-3 M
nI3- = n H3AsO3 = 4* nAs4O6 = 4* vAs4O6 / [As4O6] = 4* 25,00 mL * 9,257 *10-3 M = 9,257 *10-4 mol
[I3-]=9,257 *10-4 mol / 31,77 mL = 2,914 *10-2 M
38.2 Que influência pode ter o facto do indicador de amido ser adicionado no início ou perto do ponto de equivalência?
Se o amido fôr adicionado no início da titulação poderá reagir irreversivelmente com o iodo, o que o impedirá de mudar de côr no ponto de equivalência. [Peat S, Bourne EJ, Thrower RD Nature (1947) 159: 810-811]
39. Uma amostra de 128.6 mg de proteína (58600 g/mol) foi tratada com 2,000 mL de NaIO4 0,0487 M para reagir com todos os resíduos de serina e treonina. A solução foi depois tratada com excesso de iodeto para converter o periodato que não reagiu em triiodeto:
IO4- + 3 I-+ H2O -> IO3-+ I3- + 2 HO-
A titulação do triiodeto exigiu 823 μL de tiossulfato 0,0988 M.
39.1 Calcule o número de resíduos de serina e treonina por molécula de proteína (ajuste para o inteiro mais próximo)
nIO4- total = 2,000 mL * 0,0487 M = 9,74 *10-5 mol
nIO4- excesso = nI3- = ½ * nS2O42- = ½ * 823 *10-6 L * 0,0988 M = 4,07 *10-5 mol
nIO4- gasto = 5,67 *10-5 mol
nproteína = 128,6 mg / 58600 g.mol-1 = 2.195 *10-6 mol
(Ser/Thr) / proteína = nIO4- gasto / nproteína = 26
39.2 Quantos mg de As4O6 seriam necessários para reagir com o I3- libertado nesta experiência?
nI3- == 4,07 *10-5 mol
nAs4O6 = nI3- / 4 = 1,02 *10-5 mol
mAs4O6 = nAs4O6 * MM(As4O6)= 1,02 *10-5 mol* 395,6828 g.mol-1= 404 mg
40. Dilui-se 5,00 mL de brandy num bal;ão volumétrico de 1,000 L. O etanol de uma alíquota de 25,00 mL da solução diluída foi destilado em 50,00 mL de K2Cr2O7 0,02000 M e oxidou-se até ácido acético por aquecimento:
2 Cr2O72- + 16 H+ + 3 C2H5OH -> 4 Cr3+ + 11 H2O + 3 CH3COOH
Depois de arrefecer a solução, adicionou-se ao matraz 20,00 mL de Fe2+ 0,1253 M. Em seguida, titulou-se o excesso de Fe2+ com 7,46 mL de K2Cr2O7 0,02000 M até ao ponto final do ácido difenilaminossulfónico. Calcule a % (m/v) de etanol (46,97 g/mol) no brandy.
netanol=3/2 * nCr2O72-gasto na sua oxidação
Foi utilizado Cr2O72- em excesso:
nCr2O72- inicial = 50,00 mL * 0,02000 M = 1,000 mmol
Para determinar quanto Cr2O72- sobrou (nCr2O72-excesso) titula-se por retorno com Fe2+:
6 Fe2+ + Cr2O72- + 14 H+ → 6 Fe3+ + 2 Cr3+ + 7 H2O
nFe2+inicial= 20,00 mL * 0,1253 M = 2,506 mmol
nFe2+excesso= 6* nCr2O72-necessário para o titular = 6 * 7,46 mL * 0,0200 M = 0,8952 mmol
nCr2O72-excesso = 1/6 * n Fe2+gasto= 1/6 * (2,506 mmol - 0,8952 mmol) = 0,2685 mmol
nCr2O72-gasto na oxidação do etanol = nCr2O72- inicial - nCr2O72-excesso = 1,000 mmol - 0,2685 mmol = 0,7315 mmol
netanol=3/2 * nCr2O72-gasto na sua oxidação = 1,097 mmol
[brandy diluído] = 1,097 mmol / 25,00 mmol = 0,0439 M
ci vi = cf vf
Substituindo:
ci 5,00 * 10-3 L = 0,0439 M 1,000 L
ci = 8,78 M = 412 g /L = 41,2 g /100 mL = 41,2 %
41. Uma amostra de 0,2981 g de um antibiótico (sulfanilamida) em pó foi dissolvida em HCl e diluída a 100,0 mL. Transferiu-se uma alíquota de 20,00 mL para um matraz e adicionou-se 25,00 mL de KBrO3 0,01767 M. Juntou-se um excesso de KBr, para formar Br2, e tapou-se o matrás.
BrO3- + 5Br- + 6 H+ -> 3 Br2 + 3 H2O
Deixou-se o Br2 reagir com a sulfanilamida durante 10 minutos:
sulfanilamida + 2 Br2 -> 2 H+ + 2 Br- + sulfanilamida dihalogenada
Após este tempo, adicionou-se um excesso de KI, e titulou-se o iodo libertado com 12,92 mL de tiossulfato de sódio 0,1215 M:
Br2 + 2 I- -> I2 + 2 Br-
I2 + 2 S2O32- -> 2 I- + S4O62-
Calcule a % (m/m) de sulfanilamida no pó.
nBr2 excesso = nI2 = ½ n S2O32- = ½ * 12,92 mL * 0,1215 M = 0,7949 mmol
nBr2 inicial = 3 * nKBrO3 = 3* 25,00 mL * 0,01767 M = 1,325 mmol
nsulfanilamida = ½ nBr2 gasto = nBr2 inicial -nBr2 excesso = 1,325 mmol -0,7949 mmol = 0,530 mmol
msulfanilamida = 0,530 mmol * 172,21 g/mol = 0,0913 g
%sulfanilamida = 0,0913 g / 0,2981 g = 30,6 %
42. Uma solução amostra contém Fe(II) e Fe(III). Retiraram-se 25,00 desta amostra para um balão volumétrico de 200,0 mL, e completou-se o volume com água desionizada. Para um matrás mediu-se 15,00 mL da solução contida no balão, 20 mL de água, e tamponou-se a solução para meio fortemente ácido. Titulou-se o conteúdo do matrás com uma solução de anião permanganato 0,0203 M, tendo-se gasto 2,34 mL.
Para outro matrás mediu-se 10,00 mL da solução contida no balão, acidulou-se com HCl e adicionou-se excesso de uma solução de catião Sn2+. Após reacção e remoção do catião Sn2+ sobrante, titulou-se o conteúdo do matrás com a solução de anião permanganato 0,0203 M, tendo-se gasto 3,51 mL. Calcule a concentração da amostra em Fe2+ e Fe3+.
Determinação do Fe(II)
MnO4- + 8 H+ + 5 Fe2+ → Mn2+ + 5 Fe3+ + 4 H2O
nFe2+ = 5 * nMnO4- = 5 * 2,34 mL * 0,0203 M = 2,38 * 10-4 mol
[Fe2+] = 2,38 * 10-4 mol/ 15,00 mL = 1,59 * 10-2 M
[Fe2+]ivi =[Fe2+] f vf
ci 25,00 mL = 1,59* 10-2 M * 200,00 mL
[Fe2+]i = 0,127 M
Determinação do Fe total
Procedeu-se primeiro à redução do Fe(III) a Fe(II)
6 Cl- + Sn2+ + 2 Fe3+ → 2 Fe2+ + [SnCl6]2-
A titulação do Fe(II) foi feita como anteriormente:
MnO4- + 8 H+ + 5 Fe2+ → Mn2+ + 5 Fe3+ + 4 H2O
nFe2+ = 5 * nMnO4- = 5 * 3,51 mL * 0,0203 M = 3,56 * 10-4 mol
[Fe2+]total = 3,56 * 10-4 mol/ 10,00 mL = 3,56 * 10-2 M
[Fetotal]ivi =[Fe2+] f vf
ci 25,00 mL = 3,56* 10-2 M * 200,00 mL
[Fetotal]i = 0,285 M
[Fe3+]i = [Fetotal]i - [Fe2+]i = 0,285 M- 0,127 M = 0,158 M
 | GD Christian : Analytical Chemistry |
 | Daniel C. Harris: Quantitative Chemical Analysis |