Professor Associado, Universidade Fernando Pessoa
| Outras páginas de Química Orgânica: | |||
| Bioquímica metabólica: |

Os ácidos carboxílicos são ácidos fracos. Mesmo assim, estão entre os compostos orgânicos mais ácidos: apresentam tipicamente pKa entre 4 e 6 (comparado com 16-20 para alcoois, aldeídos e cetonas e 25 para os protões acetilénicos). A razão desta elevada acidez encontra-se parcialmente na ressonância: o anião carboxilato originado pela desprotonação do ácido é fortemente estabilizado por ressonância. O ácido terá portanto grande tendência a perder o protão, a fim de originar esta espécie muito estável:
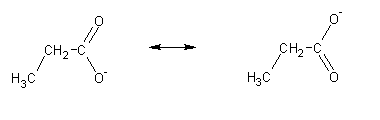
Recentemente, estudos teóricos revelaram que apenas cerca de 1/3 da estabilização do anião carboxilato é devida à ressonância. A contribuição restante deve-se ao efeito indutivo provocado pela deficiência de carga electrónica no carbono do grupo carboxilato [Holt & Karty, 2003]
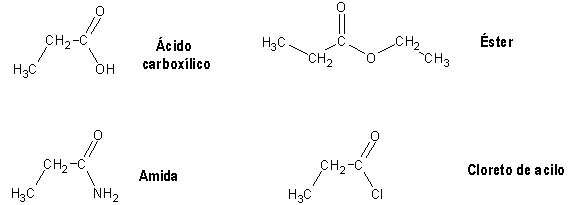
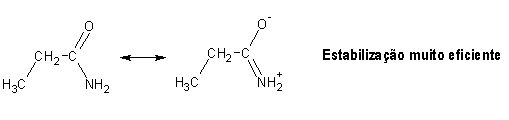
Devido à presença do grupo carbonilo, os ácidos carboxílicos e seus derivados estão sujeitos a ataque nucleofílico, tal como os aldeídos e cetonas. Entre os derivados dos ácidos carboxílicos, os cloretos de acilo serão os mais susceptíveis de ataque nucleofílico, uma vez que a grande electronegatividade do cloro retira bastante densidade electrónica ao carbono do grupo carbonilo, aumentando bastante a sua electrofilicidade. No outro extremo encontram-se as amidas: a sua baixa electronegatividade (comparada com os derivados contendo oxigénio ou cloro) torna bastante eficiente a partilha do par de electrões extra do azoto, provocando uma estabilização muito acentuada por efeito de ressonância.
A reacção mais importante dos derivados dos ácidos carboxílicos é a substituição nucleófila. Um exemplo é a hidrólise dos cloretos de acilo:
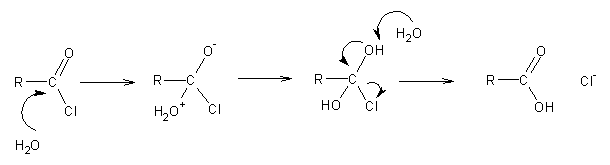
Esta reacção é extremamente rápida por causa do efeito indutor do cloro, que torna o carbonilo bastante electrofílico (ver acima).
Os ésteres podem ser facilmente preparados por condensação de um ácido carboxílico com um álcool em condições de catálise ácida:
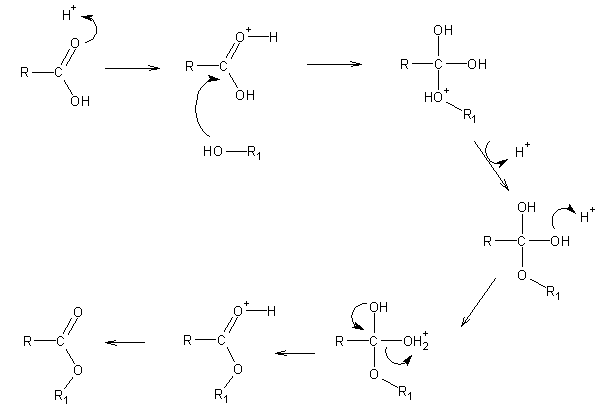
Os ésteres podem ser hidrolisados por catálise ácida. Neste caso, o mecanismo é exactamente o oposto da esterificação. A reacção é por isso reversível. Quando se pretende sintetizar o éster, remove-se a água da mmistura reaccional a fim de deslocar o equilíbrio no sentido da formação do éster. Pelo contrário, quando se pretende hidrolizar o éster, realiza-se a reacção na presença de um grande excesso de água.
A hidrólise do éster em solução básica é, no entanto, irreversível pelo que o seu estudo mais detalhado se justifica. Neste caso, a hidrólise não é realizada pela água, mas pelo anião hidróxido:
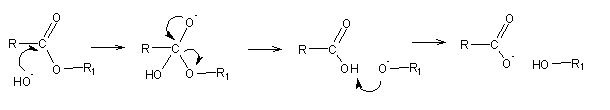
O último passo da reacção é irreversível: o carboxilato (uma base fraca) não tem nenhuma tendência a retirar o protão do álcool (um ácido muito fraco).
O processo é semelhante à síntese de ésteres:
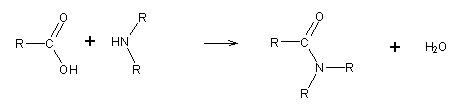
Utilizando amoníaco (NH3), obtêm-se amidas. Utilizando aminas primárias (RNH2), obtêm-se amidas monosubstituídas. Utilizando aminas secundárias (R4NH), obtêm-se amidas disubstituídas.
 | Organic
Chemistry, 7th Edition, Solomons & Fryhle Um texto clássico, pormenorizado e escrito de forma muito clara. |
 | Organic
Chemistry: a Brief Course, Carey & Atkins Um bom resumo de química orgânica. |
 | Organic Chemistry, Francis Carey Bastante pormenorizado, este livro inclui um óptimo programa de construção tridimensional de moléculas, bastante útil para o estudo da estereoquímica, conformações, etc. |
"Química Orgânica", Carlos Corrêa Centro de Investigação em Química da Universidade do Porto |