Professor Associado, Universidade Fernando Pessoa
| Outras páginas de Química Orgânica: | |||
| Bioquímica metabólica: |
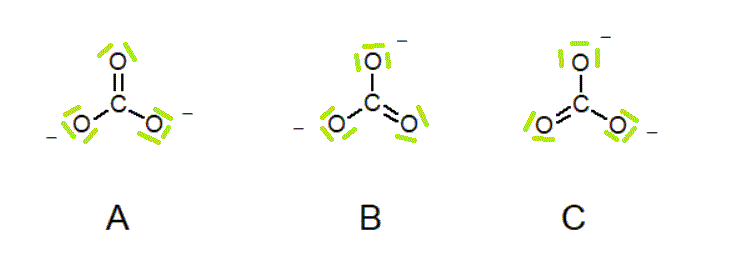
O ião carbonato CO32- pode ser representado por três estruturas de Lewis equivalentes.

Estas três estruturas são semelhantes, mas não são iguais: A posição da ligação dupla carbono-oxigénio torna-as diferentes. Quando é possível desenhar várias estruturas de Lewis equivalentes para a mesma molécula (ou ião), diz-se que essa molécula (ou ião) apresenta ressonância. Cada uma das estruturas de Lewis será uma estrutura contribuinte. A verdadeira estrutura do ião carbonato será um híbrido das estruturas A, B e C. Todas as suas ligações carbono-oxigénio têm o mesmo comprimento, e todos os oxigénios têm a mesma carga.
Que regras se devem obedecer ao escrever estruturas contribuintes?
1. Todas as estruturas deverão ter o mesmo número de electrões E OS MESMOS ÁTOMOS NAS MESMAS POSIÇÕES
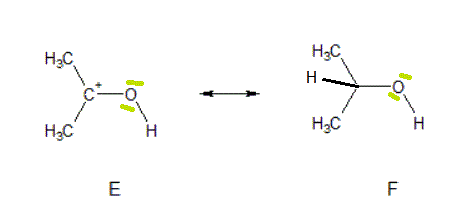
A estrutura E tem 12 electrões e a estrutura F tem 14 electrões. Além disso, existe mais um hidrogénio na estrutura F. Nada disto é permitido pela primeira regra....
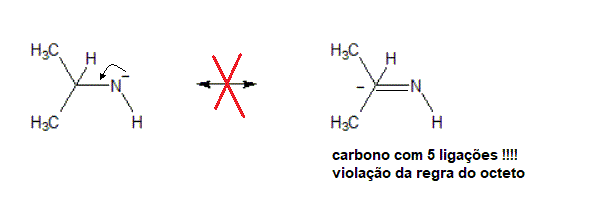
2. A regra do octeto deve ser obedecida.
3. As estruturas contribuintes mais importantes têm o maior numero possível de octetos completos:
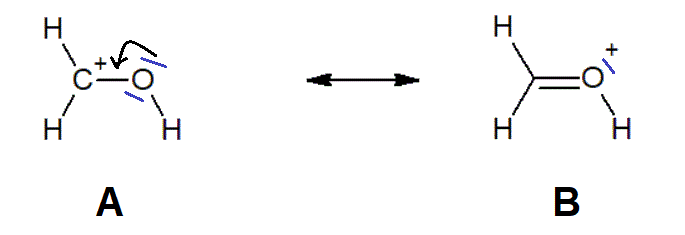
Ao contrário da estrutura A, todos os átomos da estrutura B têm octetos completos. B será portanto mais importante do que A, mesmo apesar de ter uma carga positiva num átomo electronegativo.
4. Se numa estrutura contribuinte houver carga localizada, esta deverá estar nos átomos mais apropriados: cargas negativas deverão estar nos átomos mais electronegativos, e cargas positivas deverão estar nos átomos menos electronegativos:
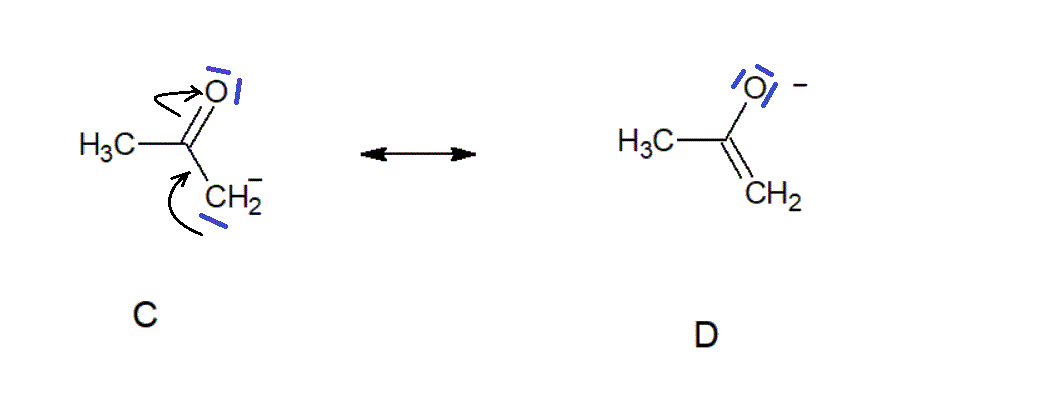
D é mais importante do que C, porque tem a carga negativa num oxigénio em vez de a ter num carbono.
5. As estruturas deverão ter o maior número possível de ligações covalentes.
6. A importância duma estrutura contribuinte diminui com o aumento do número de cargas localizadas.
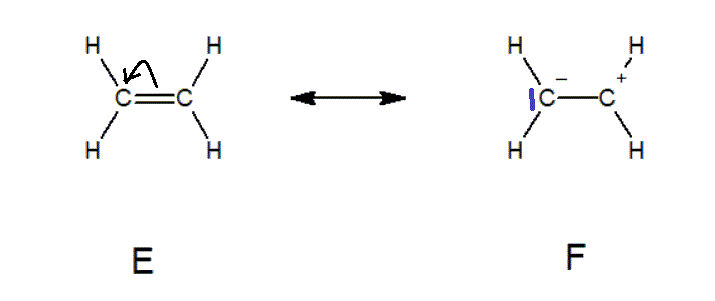
E é mais importante do que F porque não tem cargas localizadas.
7. Um híbrido de ressonância é tanto mais estável quanto maior fôr o número de estruturas contribuintes equivalentes.
8. As estruturas com cargas do mesmo sinal são tanto menos estáveis quanto mais próximas as cargas se encontrarem.
Exercícios:
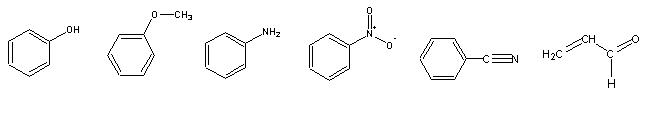
Desenhe as estruturas contribuintes mais importantes para os híbridos seguintes:
O anião benzoato é um híbrido de ressonância com muitas estruturas contribuintes. Apresentam-se na figura algumas destas estruturas:
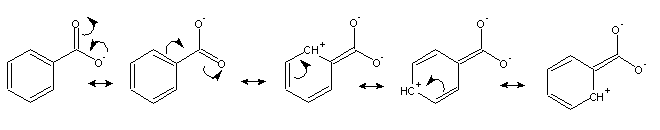
É evidente nestas estruturas que o grupo funcional carboxilato tem a capacidade de retirar carga do anel benzénico por efeito de ressonância, dando origem a deficiência electrónica nas posições orto e para do anel.
Qualquer grupo ou átomo capaz de aceitar (ou dar) electrões por efeito de ressonância vai afectar a distribuição de carga num anel aromático.
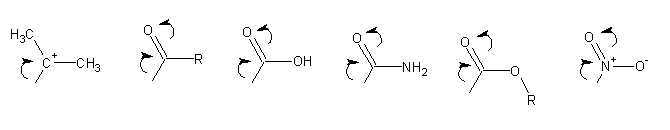
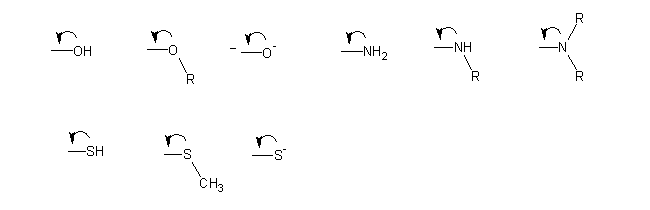
A presença destes grupos vai afectar de forma decisiva a reactividade do anel benzénico (ver Velocidade e orientação em substituição electrofílica aromática ).
 | Organic
Chemistry, 7th Edition, Solomons & Fryhle Um texto clássico, pormenorizado e escrito de forma muito clara. |
 | Organic
Chemistry: a Brief Course, Carey & Atkins Um bom resumo de química orgânica. |
 | Organic Chemistry, Francis Carey Bastante pormenorizado, este livro inclui um óptimo programa de construção tridimensional de moléculas, bastante útil para o estudo da estereoquímica, conformações, etc. |
"Química Orgânica", Carlos Corrêa Centro de Investigação em Química da Universidade do Porto |