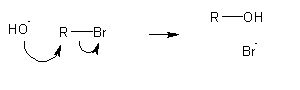
Professor Associado, Universidade Fernando Pessoa
| Outras páginas de Química Orgânica: | |||
| Bioquímica metabólica: |
Um nucleófilo (base de Lewis) é um anião ou molécula neutral que possui um par de electrões não-compartilhados. P. ex. quer HO- quer H2O podem actuar como nucleófilos reagindo com alcanos halogenados para produzir álcoois:
Muitas substâncias podem actuar como substratos de substituições nucleófilas, além dos derivados halogenados dos alcanos. Para ser reactiva, uma molécula deve possuir bons grupos migrantes. Nos alcanos halogenados o halogénio substituinte é o grupo migrante: deixa a molécula sob a forma de anião. Para ser um bom grupo migrante, o substituinte deve ser capaz de deixar a molécula sob a forma de ião (ou molécula) relativamente estável, fracamente básico. Os halogenetos são relativamente estáveis e são bases muito fracas, pelo que constituem bons grupos migrantes.
Uma reacção diz-se unimolecular quando (a pressão e temperatura constantes) a sua velocidade só depende da concentração de um dos reagentes. Isto significa que o passo limitante da reacção, i.e., o passo mais lento, não envolve colisão de moléculas. P. ex. a reacção do cloreto de terc-butilo com a água.
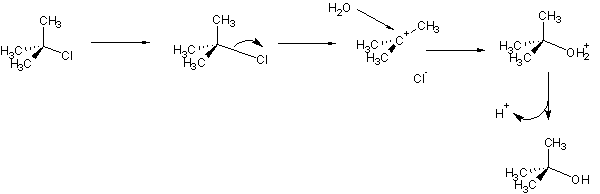
A reacção é iniciada pela saída do anião cloreto. Forma-se então um carbocatião (electrófilo muito forte), que será facilmente atacado pela água. A água substitui assim o Cl que estava ligado à molécula. A desprotonação final dá origem ao álcool.
Uma reacção diz-se bimolecular quando (a pressão e temperatura constantes) a sua velocidade depende da concentração de dois reagentes. Isto significa que o passo limitante da reacção, i.e., o passo mais lento, envolve colisão de duas moléculas. P.ex. a reacção do anião hidróxido com a clorometano:
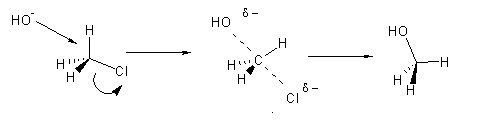
No estado de transição o carbono está rodeado por cinco substituintes: existe uma ligação parcialmente formada entre o carbono e o oxigénio, ao mesmo tempo que a ligação entre o carbono e o cloro se rompe. Nesta reacção ocorre inversão de configuração.
Todos os factores que estabilizem o estado de transição (ET) mais do que o estado inicial aceleram a reacção por diminuírem a energia de activação:
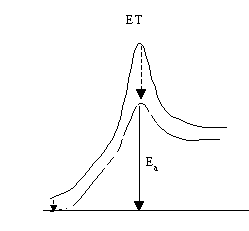
Analogamente, os factores que instabilizem mais o estado inicial do que o ET aceleram a reacção.
Portanto serão favoráveis à reacção SN1:
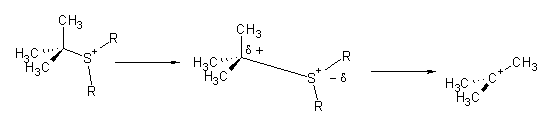
Neste caso o estado inicial (que tem a carga mais concentrada no S) será mais estabilizado por um solvente polar do que o estado de transição em que o S se está a afastar do carbono, uma vez que neste estado a carga se encontra mais dispersa.
Em primeira aproximação, basta escolher condições menos propícias a SN1:
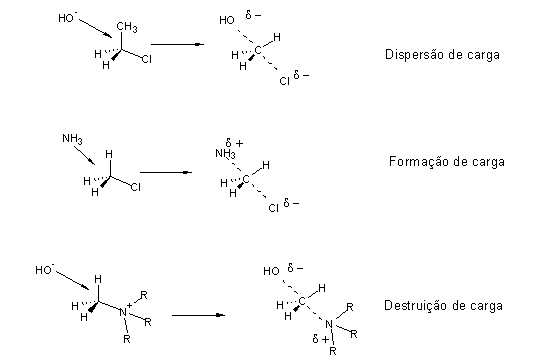
Grupo migrante |
pKa do acido conjugado |
|
|---|---|---|
|
<0 |
Bons grupos migrantes |
I- |
||
Br- |
||
H2O |
||
Me2S |
||
Cl- |
||
CF3CO2- |
0,2 |
|
H2PO4- |
2 |
|
CH3CO2- |
4,8 |
|
CN- |
9,1 |
Fracos grupos migrantes |
NH3 |
9,2 |
|
|
10 |
|
RNH2, R3N |
10 |
|
C2H5S- |
10,6 |
|
HO- |
15,7 |
Maus.. |
CH3O- |
15 |
|
NH2- |
36 |
Péssimos... |
CH3- |
49 |
| Óptimos | I- , HS-, RS- |
| Bons | Br- , HO- , RO- , CN- , N3- |
| Razoáveis | NH3 , RCO2- , F- , Cl- |
| Fracos | H2O , ROH |
| Muito fracos | RCO2H |
Um solvente designa-se prótico se possui hidrogénios ligados a átomos bem electronegativos (normalmente oxigénio). P. Ex:
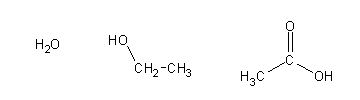
Estes hidrogénios têm todos um certo carácter ácido, pelo que podem formar pontes de hidrogénio e solvatar espécies com carga negativa:
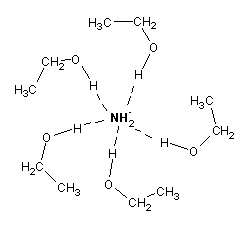
Os nucleófilos bem solvatados são menos reactivos: a carga encontra-se mais deslocalizada, e a camada de moléculas de solvente à sua volta dificulta o ataque nucleofílico: é necessário retirar moléculas de solvente para haver espaço para ceder o par de electrões a outra espécie.
Um solvente aprótico não tem este tipo de hidrogénios. P. Ex.:
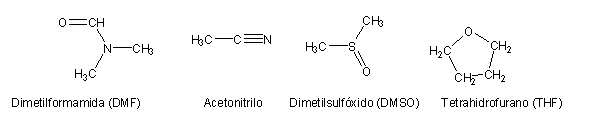
Portanto, os nucleófilos carregados negativamente não sofrerão perda de reactividade nestes solventes. Por isso, realiza-se SN2 preferencialmente em solventes polares apróticos. Os solventes polares apróticos mantêm a capacidade de estabilizar espécies de carga positiva, pelo que além disso ajudarão a estabilizar o estado de transição.
 | Organic
Chemistry, 7th Edition, Solomons & Fryhle Um texto clássico, pormenorizado e escrito de forma muito clara. |
 | Organic
Chemistry: a Brief Course, Carey & Atkins Um bom resumo de química orgânica. |
 | Organic Chemistry, Francis Carey Bastante pormenorizado, este livro inclui um óptimo programa de construção tridimensional de moléculas, bastante útil para o estudo da estereoquímica, conformações, etc. |
"Química Orgânica", Carlos Corrêa Centro de Investigação em Química da Universidade do Porto |