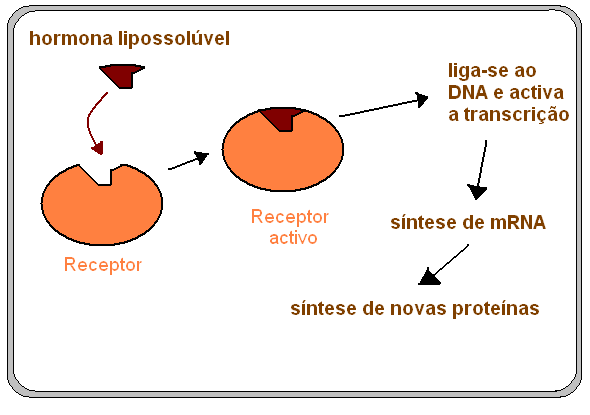
|
|
Pelo contrário, as hormonas hidrossolúveis não podem atravessar a membrana, e os
seus receptores são proteínas inter-membranares. Neste caso, as mudanças conformacionais provocadas pela ligação da hormona desencadeiam processos rápidos de activação (ou desactivação) de proteínas já presentes na célula. Estas hormonas actuam por isso muito rapidamente (segundos a minutos). A transdução do sinal hormonal pode ser efectuada de várias formas:
| abertura de canais iónicos. A entrada de iões (Na+, K+, Cl-, Ca2+) modifica o potencial de membrana da célula. Além disso, quando o Ca2+ se liga à calmodulina activa esta proteína, que por sua vez activará outras proteínas. | |
| fosforilação de proteínas intercelulares por parte de um domínio do receptor com actividade de tirosina cinase. As proteínas fosforiladas activarão outras proteínas, dando origem à resposta final. | 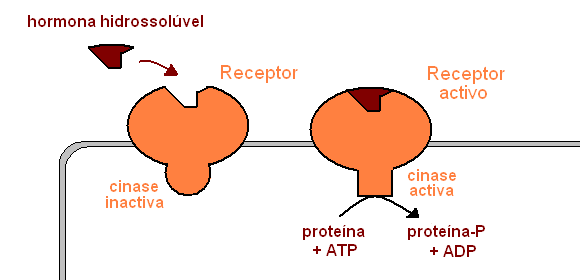 |
| activação de cinases citoplasmáticas. | |
| activação de proteínas G. As proteínas G contêm três sub-unidades, uma das quais se encontra ligada a GDP. Quando uma proteína G se liga a um receptor activo, a sua sub-unidade alfa sofre uma mudança conformacional, e troca o seu GDP por um GTP. A sub-unidade alfa, quando ligada ao GTP, separa-se das outras sub-unidades, torna-se capaz de activar diferentes mecanismos de transdução de sinal: | 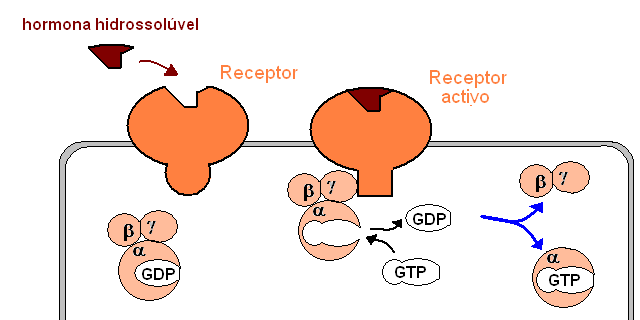 |
| activação de adenilil (ou guanilil) ciclases, com subsequente produção dos mensageiros secundários cAMP e cGMP. | 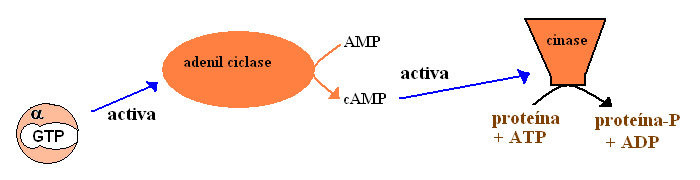 |
| activação da fosfolipase C. Esta fosfolipase hidroliza um fosfolípido particular, e produz os mensageiros secundários inositol trifosfato (IP3) e diacilglicerol (DAG). DAG activa a proteína cinase C, e o IP3 faz com que o retículo endoplasmático largue Ca2+ para o citoplasma. | 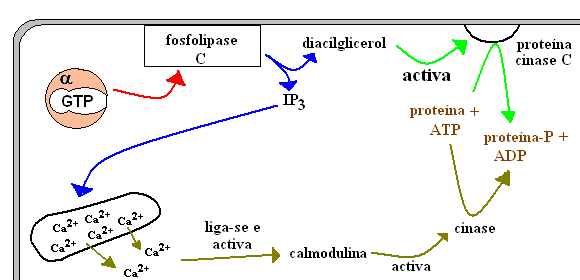 |
 | Human Physiology: The Mechanisms of Body function Um bom texto para alunos dos primeiros anos de um curso universitário. |
 | Textbook of Medical Physiology A "Bíblia" da Fisiologia Humana. Um texto excelente e muito pormenorizado, indispensável para estudantes de Medicina e Enfermagem |