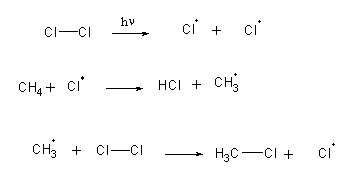
Professor Associado, Universidade Fernando Pessoa
| Outras páginas de Química Orgânica: | |||
| Bioquímica metabólica: |
Reacções típicas dos alcenos
Os alcanos também são conhecidos por parafinas, uma palavra derivado do latim e que significa “com pouca afinidade”. Como esse nome indica, são substâncias pouco reactivas. As duas reacções mais relevantes do ponto de vista prático são:
A combustão, em que os alcanos reagem com O2, produzindo CO2 e libertando grandes quantidades de energia.
A halogenação. É uma reacção que ocorre por um mecanismo de radicais livres:
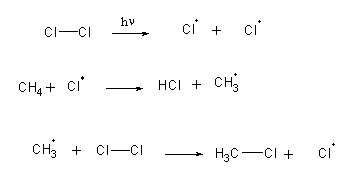
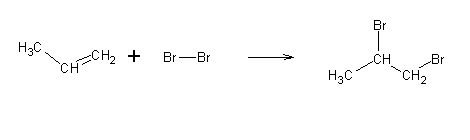
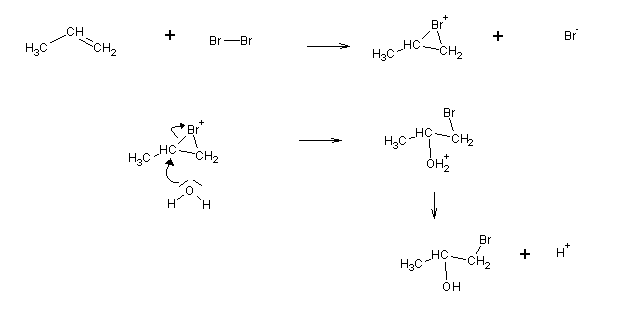
A reacção ocorre via carbocatiões. A nuvem p polariza a ligação Br-Br, provocando a sua dissociação heterolítica, e a formação de um carbocatião.
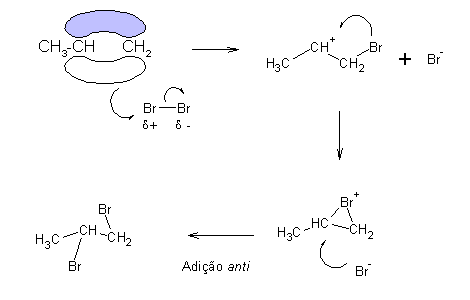
Br- (uma base de Lewis) adiciona então ao carbocatião. A adição efectua-se do lado oposto àquele a que se encontra o outro átomo de Br (adição anti), devido a razões estereoquímicas. No caso do cloro a reacção é menos estereoespecífica.
Quando se faz um halogénio reagir com um alceno em meio aquoso forma-se uma halidrina: uma molécula com um átomo de halogéneo e um grupo álcool.
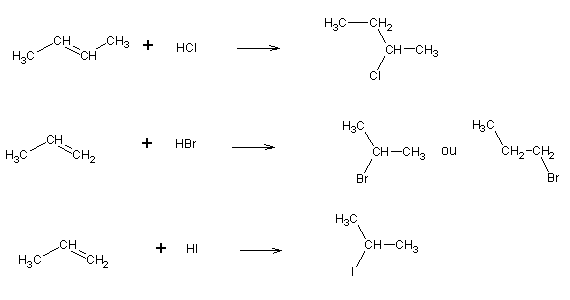
A adição de halogenetos de hidrogénio progride por carbocatiões, tal como a formação das halidrinas (ver adiante). Nestes casos observa-se a regra de Markovnikov: quando um alceno substituído assimetricamente reage com um halogeneto de hidrogénio, o hidrogénio liga-se ao carbono que tem o maior número de hidrogénios, e o halogénio ao carbono com menos hidrogénios.
No caso do HBr, a adição pode ocorrer ao contrário da regra de Markovnikov em condições especiais. Isto ocorre quando se efectua a reacção em presença de radicais (p. ex: peróxidos). Nestes casos, o HBr é cindido homoliticamente pelos radicais presentes, dando origem a dois radicais: H· e Br·. O radical Br· adicionará ao carbono com mais hidrogénios (por ter mais espaço livre à sua volta) dando origem a um radical centrado no outro carbono da ligação. Este radical reagirá então com H·, completando a reacção.
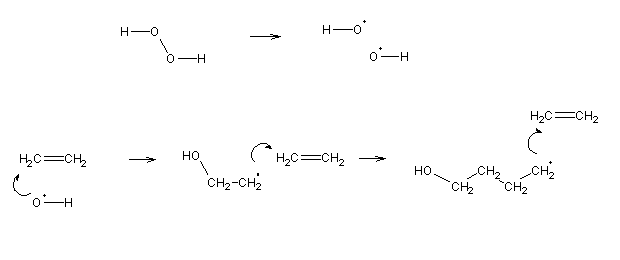
A polimerização é uma reacção radicalar. Pode ser convenientemente iniciada por cisão fotolítica do peróxido de hidrogénio. Os radicais assim formados atacarão as ligações duplas, originando novos radicais, que voltarão a atacar outras moléculas de monómero. A reacção repetir-se-á umas centenas de vezes, dando origem a misturas de polímeros de tamanhos variáveis. A reacção terminará quando dois radicais reagirem entre si, dando origem a uma ligação simples.
Por hidratação, as olefinas originam alcoóis:
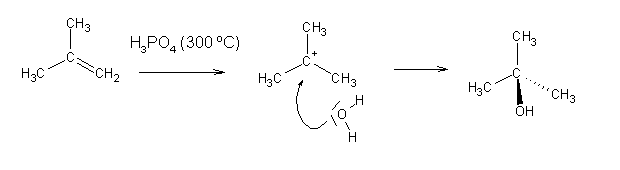
Usam-se ácidos fortes como catalizadores da reacção: o H+ adiciona à ligação dupla, originando um carbocatião que será atacado por água dando origem ao álcool correspondente.
O ozono é um fortíssimo agente oxidante. A reacção de um alceno com ozono, após tratamento com ácido e zinco metálico, dá origem a dois compostos carbonilo (aldeídos ou cetonas). A análise destes compostos permite identificar a posição da ligação dupla no alceno original, uma vez que os grupos carbonilo se formam nos carbonos que se encontravam ligados por uma ligação dupla.
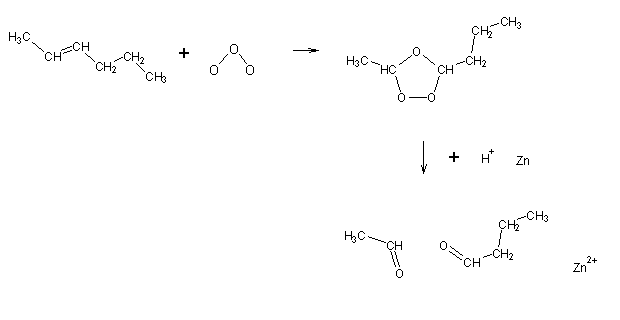
É possível efectuar a redução de um alceno ao alcano correspondente utilizando hidrogénio molecular como agente redutor na presença de catalizadores (de Pt, Ni, Rh).
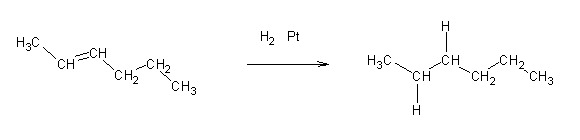
Por oxidação com KMnO4 ou OsO4 é possível preparar glicóis (1,2-dióis) a partir de alcenos:
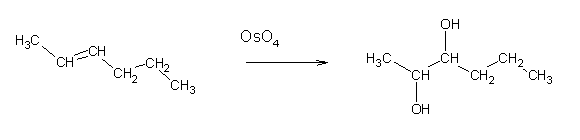
Esta reacção é estereospecífica: se se oxidar um cicloalceno com KMnO4 ou OsO4, o glicol que se forma possuirá sempre os dois grupos OH em posição cis. A oxidação com KMnO4 apresenta o inconveniente de frequentemente provocar a oxidação completa do alceno a ácidos carboxílicos.
Alquilar uma molécula consiste em introduzir-lhe grupos alquilo (i.e. radicais metilo, etilo, propilo, etc.). Os alcenos podem ser alquilados sob catálise ácida a baixas temperaturas.
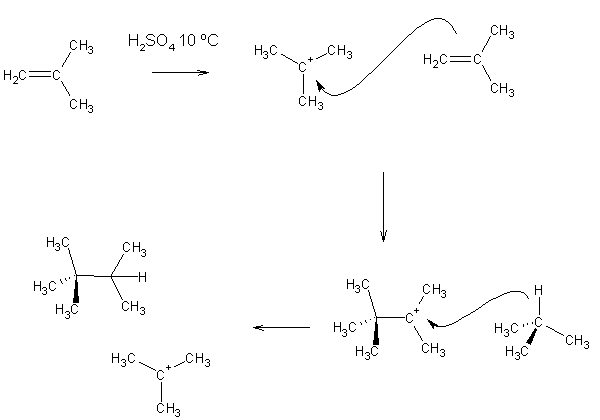
A alquilação é utilizada para obter compostos ramificados.
A ligação tripla C=C é, como a ligação dupla, alvo fácil de ataque electrófilo. A adição a alcinos é normalmente mais lenta do que a alcenos.
Além dos ácidos, requer outros catalizadores. Utiliza-se normalmente Hg2+. Este complexa o alcino, baixando a densidade electrónica dos carbonos, permitindo assim o ataque nucleófilo por H2O. Ao contrário do que acotece com alcenos, o produto da hidratação de um alcino não é um álcool, mas um aldeído ou cetona.
Bases fortes, como o NH2-, podem remover protões dos acetilenos terminais, dando o anião acetileto:
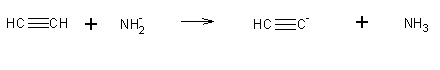
Comparemos a sua força com a de outros “ácidos”:
| CH4 | CF3H | HC=CH | Fenol | CH3COOH | |
| pKa | 43 | 28 | 25 | 10 | 4.76 |
Os protões terminais do acetileno são invulgarmente ácidos , quando comparados com outros protões ligados a carbonos. Como é que se pode explicar este facto?
Pode-se encontrar uma explicação para isto nas configurações electrónicas dos aniões: o par de electrões não compartilhado no anião HC=C- ocupa uma orbital sp. É uma orbital com forte carácter s, i.e., os electrões encontram-se fortemente atraídos pelo núcleo, apresentando por isso pouca tendência para serem compartilhados com um ácido de Lewis. No caso do anião originado pela protonação do CH4, o par de electrões encontrar-se-á numa orbital sp3, com menos carácter s, i.e., com maior tendência a partilhar os seus electrões com um ácido. Por isso, HC=C- será uma base mais fraca do que o CH3-, i.e. o acetileno será um ácido mais forte do que o CH4.
 | Organic
Chemistry, 7th Edition, Solomons & Fryhle Um texto clássico, pormenorizado e escrito de forma muito clara. |
 | Organic
Chemistry: a Brief Course, Carey & Atkins Um bom resumo de química orgânica. |
 | Organic Chemistry, Francis Carey Bastante pormenorizado, este livro inclui um óptimo programa de construção tridimensional de moléculas, bastante útil para o estudo da estereoquímica, conformações, etc. |
"Química Orgânica", Carlos Corrêa Centro de Investigação em Química da Universidade do Porto |