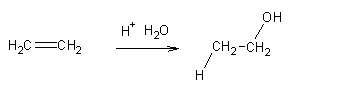
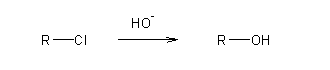
Substituição nucleófila. No entanto, esta reacção só é útil com substratos incapazes de reagir rapidamente por E2.
Professor Associado, Universidade Fernando Pessoa
| Outras páginas de Química Orgânica: | |||
| Bioquímica metabólica: |
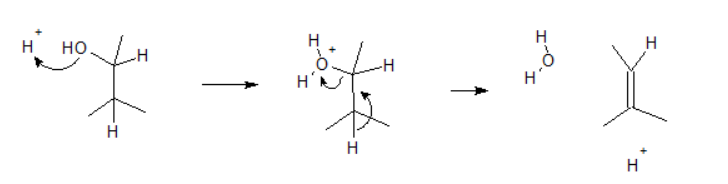
Já conhecemos várias formas de sintetizar álcoois:
|
|
|
Substituição nucleófila. No entanto, esta reacção só é útil com substratos incapazes de reagir rapidamente por E2. |
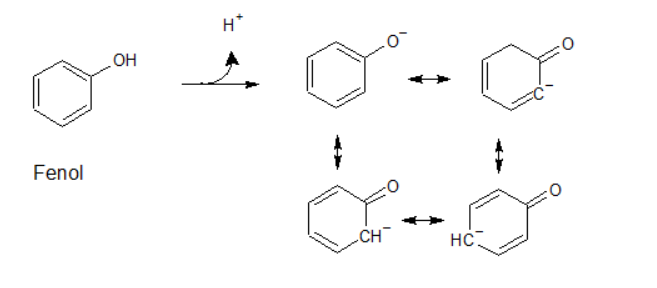
Na presença de bases fortes, os álcoois actuam como dadores de protões. Os álcoois são geralmente ácidos ligeiramente mais fracos do que a água, com valores de pKa entre 16 e 18. Os álcoois são compostos versáteis, e podem ser usados como material de partida para a preparação de uma grande variedade de compostos. Os fenóis são bastante mais ácidos (pKa à volta de 10), em grande parte devido à estabilização da carga negativa por ressonância no anel aromático:
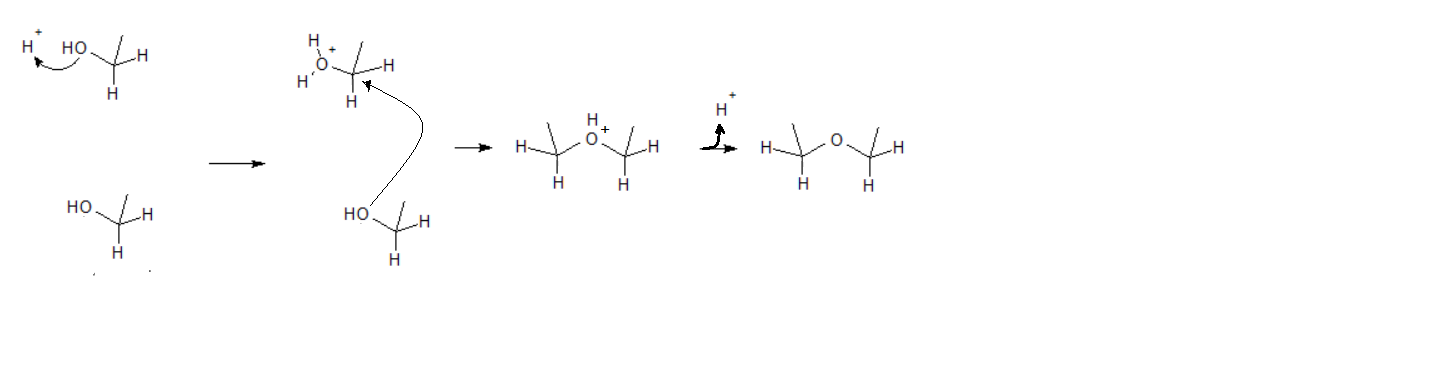
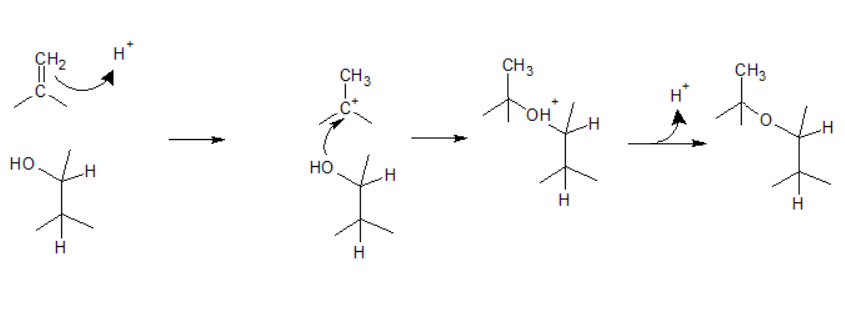
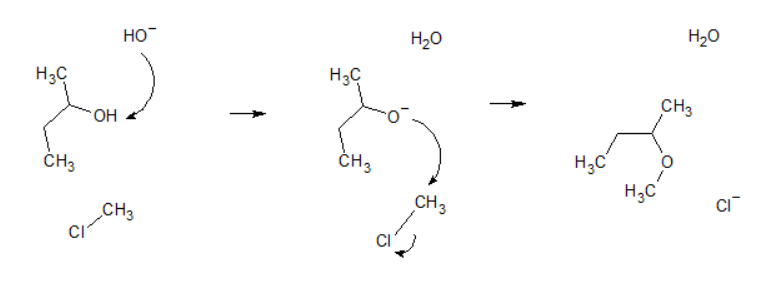
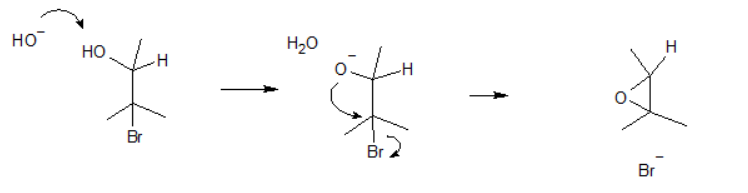
A oxidação de álcoois pode dar origem a um aldeído, uma cetona, ou um ácido carboxílico, dependendo do álcool, do agente oxidante e das condições da reacção. Normalmente usam-se compostos de Cr(VI) como oxidantes. A reacção de um álcool primário com ácido crómico (preparado por acidificação de soluções de cromato, CrO42-, ou dicromato, Cr2O72-) dá origem principalmente ao ácido carboxílico correspondente:
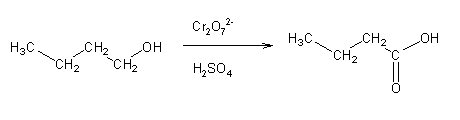
Para se oxidar um álcool primário apenas até ao estado de aldeído não se pode usar ácido crómico, pois este é um oxidante muito forte. Em vez deste, usam-se outras espécies de Cr(VI) (por exemplo clorocromato de piridínio - PCC - ou dicromato de piridínio - PDC) em solução anidra.
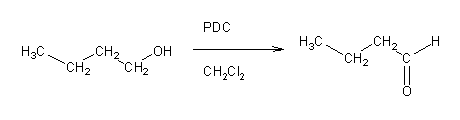
Os álcoois secundários são oxidados a cetonas pelos mesmos reagentes que oxidam os álcoos primários:
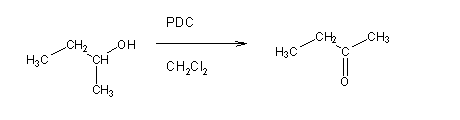
Os álcoois terciários, por não possuírem hidrogénio ligado ao carbono hidroxilado, não são facilmente oxidados.
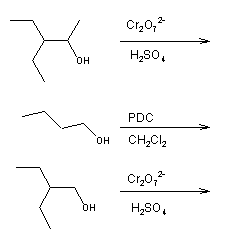
Exercícios: Preveja os principais produtos orgânicos das seguintes reacções:
 | Organic
Chemistry, 7th Edition, Solomons & Fryhle Um texto clássico, pormenorizado e escrito de forma muito clara. |
 | Organic
Chemistry: a Brief Course, Carey & Atkins Um bom resumo de química orgânica. |
 | Organic Chemistry, Francis Carey Bastante pormenorizado, este livro inclui um óptimo programa de construção tridimensional de moléculas, bastante útil para o estudo da estereoquímica, conformações, etc. |
"Química Orgânica", Carlos Corrêa Centro de Investigação em Química da Universidade do Porto |