Professor Associado, Universidade Fernando Pessoa
| Outras vias metabólicas: | |||
| Química Orgânica: |
Além de serem constituintes das proteínas os aminoácidos podem ser usados como precursores de moléculas biológicas azotadas: hemos, nucleótidos, glutationa, animas fisiologicamente activas, etc.
O excesso de aminoácidos da dieta não é armazenado nem excretado: é convertido em piruvato, oxaloacetato, a-cetoglutarato, etc. Consequentemente, os aminoácidos são também precursores de glucose, ácidos gordos e corpos cetónicos. Podem por isso ser usados também para produção de energia.
O processo envolve a eliminação do grupo amina (desaminação), incorporação do amónio assim produzido em ureia para posterior excreção e conversão do esqueleto carbonado em intermediários metabólicos.
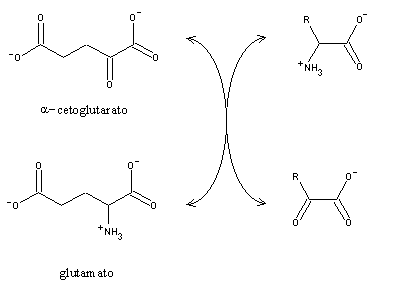
A desaminação da maior parte dos aminoácidos envolve uma transaminação prévia, que consiste na transferência do seu grupo amino para um a-cetoácido, produzindo o aminoácido correspondente ao a-cetoácido e o a-cetoácido correspondente ao aminoácido original. Geralmente o aceitador do grupo amina é o a-cetoglutarato, que é convertido em glutamato:
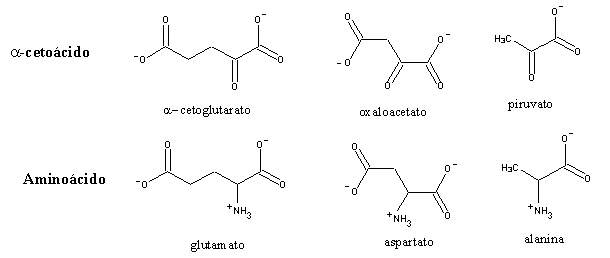
As aminotransferases usam piridoxal-5'-fosfato, um derivado da vitamina B6. O piridoxal está também envolvido em reacções de descarboxilação de aminoácidos, e de eliminação das suas cadeia laterais. É também o cofactor envolvido na reacção da glicogénio fosforilase, embora neste caso o mecanismo de actuação seja diferente. As aminotransferases são específicas para cada tipo de aminoácido, produzindo os a-cetoácidos correspondentes. No entanto, a maioria só aceita a-cetoglutarato ou (em menor extensão) oxaloacetato, como aceitador de grupo amina, produzindo glutamato ou aspartato. Por conseguinte, os grupos amina da maior parte dos aminoácidos são utilizados para produzir glutamato ou aspartato, que por sua vez podem ser interconvertidos pela glutamato-aspartato aminotransferase.
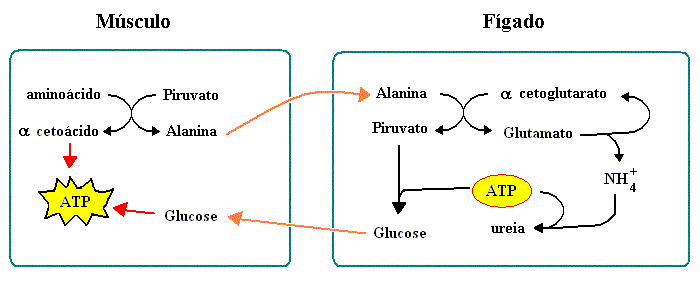
Existe um grupo de aminotransferases musculares que usa piruvato (que também é um a-cetoácido) como aceitador de amina. O aminoácido produzido por estas (a alanina), é lançado para a corrente sanguínea e absorvido pelo fígado, onde é transaminado a piruvato, que será usado na gluconeogénese. A glucose assim produzida é depois oxidada a piruvato pelo músculo, completando o ciclo da alanina. O grupo amina é depois utilizado para a síntese da ureia. O resultado do ciclo da alanina é o transporte de azoto do músculo para o fígado.
A transaminação conserva os grupos amina. A desaminação é levada a cabo principalmente pela glutamato desidrogenase, uma enzima mitocondrial que usa quer NAD+ quer NADP+.
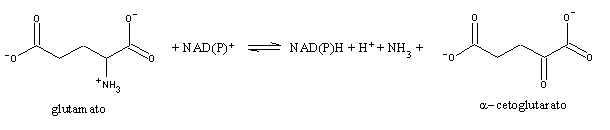
O azoto libertado sob a forma de amoníaco nesta reacção deve ser excretado. Muitos animais aquáticos excretam-no simplesmente sob a forma de amónio. Outros animais, que não têm tanta água à sua disposição, convertam o amónio em produtos menos tóxicos, e que por isso não precisam de tanta água para serem excretados. Um desses produtos é a ureia.
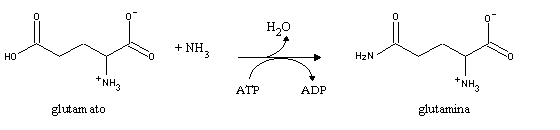
Para repôr os níveis de glutamato, outros aminoácidos reagem com o a-cetoglutarato por transaminação. O resultado é o progressivo esgotamento das reservas de a-cetoglutarato e glutamato, com consequências particularmente lesivas a nível cerebral.
A ureia é sintetizada no fígado, que depois a secreta para a corrente sanguínea, de onde será excretada pelo rim. A reacção global do ciclo da ureia é:
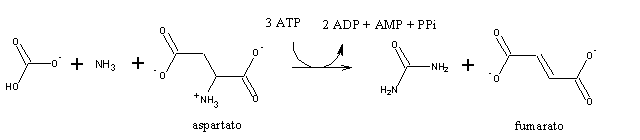
O primeiro passo é a formação de carbamoil-fosfato, uma forma activada de azoto:
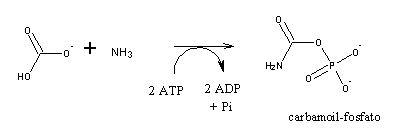
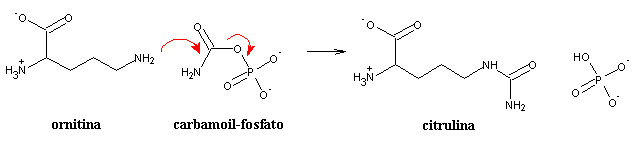
O grupo carbamoil é então transferido para a ornitina para produzir citrulina. Esta duas moléculas são aminoácidos "especiais", i.e., não fazem parte da estrutura de proteínas.
Estas duas primeiras reacções ocorrem na mitocôndria. A citrulina é então transferida para o citoplasma, onde ocorre o resto do ciclo.
O segundo átomo de azoto presente na ureia é proveniente do aspartato:
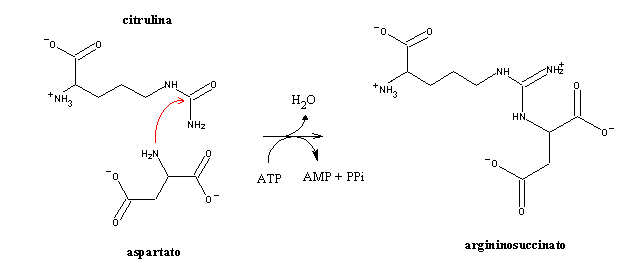
Nesta reacção o ATP é hidrolizada a AMP, em vez de ADP (como acontece normalmente). Como o AMP pode receber um fosfato do ATP, dando origem a 2 ADP, hidrolizar ATP a AMP é equivalente a hidrolizar 2 ATP a 2 ADP.
O argininosuccinato é depois clivado em arginina e fumarato:
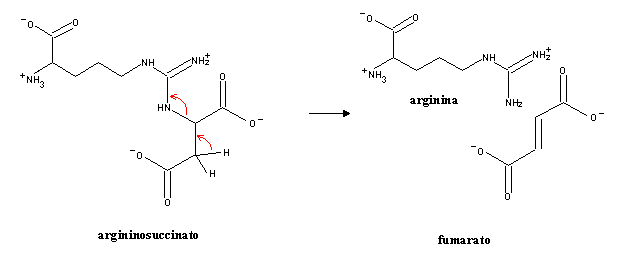
O fumarato pode entrar no ciclo de Krebs para produzir NADH e oxaloacetato, que por sua vez pode ser reconvertido em aspartato por transaminação.
A hidrólise da arginina produz ureia e ornitina, que depois de reentrar na mitocôndria pode recomeçar o ciclo.
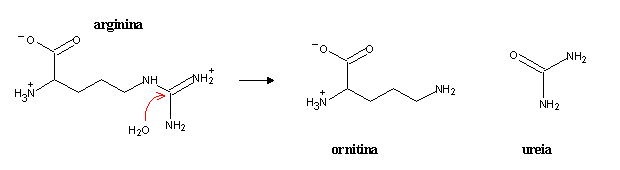
O ciclo da ureia tem um elevado custo energético, equivalente à hidrólise de 4 ATP a 4 ADP. No entanto, este custo pode ser recuperado na cadeia transportadora de electrões, uma vez que um NADH é produzido na desaminação do glutamato e outro NADH na posterior oxidação do fumarato a oxaloacetato, o que é equivalente a cerca de 6 ATP.
 |
Biochemistry,
by Donald Voet & Judith Voet Um excelente livro. Expõe a Bioquímica com referências constantes à química orgânica e à lógica bioquímica. A inspiração destas páginas.... Particularmente indicado a estudantes de Licenciaturas em Bioquímica, Ciências Farmacêuticas ou Química. |
 |
Biochemistry,
Stryer Um texto clássico, frequentemente actualizado e re-editado. |
 |
Textbook
of Biochemistry with Clinical Correlations, Thomas Devlin Aconselhado a estudantes de licenciaturas em Medicina, Enfermagem, etc. Imensos exemplos da aplicação da bioquímica a casos clínicos |
 |
Principles
of Biochemistry, Lehninger Um texto clássico, frequentemente actualizado e re-editado. |